题目内容
18.(1)将过量的铜片加入到400ml1.0mol/L的稀硝酸中,能产生标状下的气体多少升?(2)在上述反应后的溶液中再加入200ml1.0mol/L的稀硫酸,反应后铜还有剩余,则又可以产生标状下的气体多少升?
分析 (1)Cu和稀硝酸反应生成硝酸铜、NO和水,根据硝酸和NO之间的关系式计算生成NO的体积;
(2)酸性条件下,硝酸根离子和Cu反应生成硝酸铜、NO和水,根据氢离子、硝酸根离子之间的关系进行过量计算,然后再根据不足量的物质计算生成NO体积.
解答 解:(1)Cu和稀硝酸反应生成硝酸铜、NO和水,反应方程式为3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O
,设生成NO体积为x,
3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O
8mol 44.8L
1.0mol/L×0.4L x
8mol:44.8L=( 1.0mol/L×0.4L ):x
x=$\frac{1.0mol/L×0.4L×44.8L}{8mol}$=2.24L,
答:能产生标况下的气体体积为2.24L;
(2)第一次反应后的溶液中n(NO3-)=$\frac{3}{4}$n(HNO3)=$\frac{3}{4}$×1.0mol/L×0.4L=0.3mol,0.3mol硝酸根离子完全反应需要1.2mol氢离子,加入稀硫酸后,溶液中n(H+)=1.0mol/L×0.2L×2=0.4mol<1.2mol,所以氢离子不足量,根据氢离子和NO之间的关系式计算,设NO的体积为y,
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
8mol 44.8L
0.4mol y
8mol:44.8L=0.4mol:y
y=$\frac{44.8L×0.4mol}{8mol}$=2.24L
答:又可以产生标状下的气体2.24L.
点评 本题考查化学方程式的有关计算,为高频考点,侧重考查学生分析计算能力,正确判断过量问题是解本题关键,注意(2)题要先过量计算,为易错题.

( )
①分子中具有7个碳原子的芳香烃 ②分子中具有4个碳原子的烷烃
③分子中具有5个碳原子的烷烃 ④分子中具有8个碳原子的烷烃.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅤⅠA | ⅤⅡA | 0 |
| 1 | A | |||||||
| 2 | B | C | D | E | ||||
| 3 | F | G | H | I | J | K | ||
| 4 | L | M |
(2)写出C元素的气态氢化物与I元素的最高价氧化物的水化物反应的化学方程式:2NH3+H2SO4=(NH4)2SO4.
(3)将C、D、E三种元素的氢化物按还原性增强的顺序排列为HF<H2O<NH3.(用化学式表示)
(4)I2-、J-、L+、M2+等微粒中,半径最大的是S2-(填离子符号).
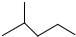 表示的分子式结构简式名称是C6H14、(CH3)2CHCH2CH2CH3、2-甲基戊烷.
表示的分子式结构简式名称是C6H14、(CH3)2CHCH2CH2CH3、2-甲基戊烷.(2)含有杂质的工业乙醇的蒸馏装置中,玻璃仪器有酒精灯、蒸馏烧瓶、冷凝管、尾接管、锥形瓶.
(3)为研究某有机物A的组成与结构,进行了如下实验:
| 实验步骤 | 解释或实验结论 |
| (1)称取A物质 18.0g,升温使其汽化,测其密度是相同条件下H2的45倍. | 试通过计算填空: ?A的相对分子质量为:90 |
(2)A的核磁共振氢谱如图: | ?A中含有4种氢原子 |
| A. | 碳酸氢钠 | B. | 二氧化硅 | C. | 甘氨酸 | D. | 甲烷 |
| A. | H2O | B. | HF | C. | NH3 | D. | PH3 |
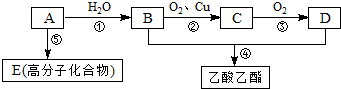
 .
.