题目内容
下列反应的离子方程式正确的是 ( )
A.NaAlO2溶液中通入过量的CO2:2AlO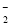 +3H2O+CO2===2Al(OH)3↓+CO
+3H2O+CO2===2Al(OH)3↓+CO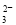
B.明矾溶液中滴加Ba(OH)2溶液至SO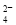 完全沉淀:Al3++Ba2++SO
完全沉淀:Al3++Ba2++SO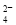 +3OH-===BaSO4↓+Al(OH)3↓
+3OH-===BaSO4↓+Al(OH)3↓
C.200 mL 2 mol/L的FeBr2溶液中通入11.2 L标准状况下的氯气:
4Fe2++6Br-+5Cl2=4Fe3++3Br2+10Cl-
D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:
3ClO-+2Fe(OH)3===2FeO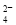 +3Cl-+H2O+4H+
+3Cl-+H2O+4H+
C
【解析】
试题分析:A.NaAlO2溶液中通入过量的CO2: AlO +2H2O+CO2==Al(OH)3↓+HCO3-,错误;B.明矾溶液中滴加Ba(OH)2溶液至SO
+2H2O+CO2==Al(OH)3↓+HCO3-,错误;B.明矾溶液中滴加Ba(OH)2溶液至SO 完全沉淀,不符合微粒反应的个数比关系,应该是:Al3++2Ba2++2SO
完全沉淀,不符合微粒反应的个数比关系,应该是:Al3++2Ba2++2SO +4OH-===2BaSO4↓+AlO2-+ 2H2O,错误;C.因为还原性:Fe2+>Br-,n(FeBr2)=0.4mol,n(Cl2)=0.5mol,所以氯气不足量,应该使还原性弱的书写反应,任何才是还原性弱的发生反应。离子方程式正确。D.在强碱溶液中不会大量存在H+,错误。
+4OH-===2BaSO4↓+AlO2-+ 2H2O,错误;C.因为还原性:Fe2+>Br-,n(FeBr2)=0.4mol,n(Cl2)=0.5mol,所以氯气不足量,应该使还原性弱的书写反应,任何才是还原性弱的发生反应。离子方程式正确。D.在强碱溶液中不会大量存在H+,错误。
考点:考查离子方程式书写的正误判断的知识。

(8分)海水中不仅含有丰富的非金属元素资源,(如Cl,Br,I等),还含有丰富的金属元素资源(如Na,Mg,Fe,Cr等),
(1)海水晒盐的原理是: ;与Na,Cl同周期,且简单离子半径最小的离子结构示意图: (2)晒出的粗盐常混有MgSO4,CaSO4等杂质,为了得到精制盐,则提纯过程操作步骤和加入试剂的顺序是: ;(填序号)
①加稀HCl滤液至酸性,②过滤除去杂质,③加过量NaOH溶液,④加过量Na2CO3溶液⑤加过量BaCl2溶液⑥溶解,⑦蒸发结晶;
(3)晒盐得到的母液(盐卤)中含有丰富的镁元素,但其中常混有Fe2+,Cr3+等,为富集镁使其转化力MgCl2晶体。
有关资料:
M(OH)n | pH | |
开始沉淀 | 沉淀完全 | |
Fe(OH)2 | 7.6 | 9.6 |
Fe(OH)3 | 2.7 | 3.7 |
Mg(OH)2 | 9.5 | 11.0 |
Cr(OH)3 | 4.3 | 5.0 |
为了有效除去杂质离子,又不引入新的杂质离子,且能满足“绿色化学理念”,
则最佳试剂选择和操作是:
①先加 ;目的是 ;
②再加 ;目的是 ;
③过滤后,为能得到纯净Mg Cl2晶体,采用的操作方法是: ;
.利用实验器材(规格和数量不限),能完成相应实验的一项是( )
| 实验器材(省略夹持装置) | 相应实验 |
A | 烧杯、玻璃棒、蒸发皿 | 硫酸铜溶液的浓缩结晶 |
B | 烧杯、玻璃棒、胶头滴管、滤纸 | 用盐酸除去硫酸钡中的少量碳酸钡 |
C | 烧杯、玻璃棒、胶头滴管、容量瓶 | 用固体氯化钠配制0.5mol/L的溶液 |
D | 烧杯、玻璃棒、胶头滴管、分液漏斗 | 用溴水和CCl4除去NaBr溶液中的少量NaI |
 的盐酸和
的盐酸和 溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为V(甲):V(乙)=1:2,则加入铝粉的质量为
溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为V(甲):V(乙)=1:2,则加入铝粉的质量为 mol
mol
 Al(OH)3
Al(OH)3 之间有如下图所示转化关系(部分反应中生成的水已略去)。
之间有如下图所示转化关系(部分反应中生成的水已略去)。
 和C中Fe元素均为+2价,则
和C中Fe元素均为+2价,则 中碳元素的化合价为______
中碳元素的化合价为______ 2Cu+SO2反应制取粗铜,当有32gCu2S消耗时,电子转移数目是 。
2Cu+SO2反应制取粗铜,当有32gCu2S消耗时,电子转移数目是 。