��Ŀ����
��13�֣�ͭ���仯�����������������й㷺Ӧ�ã�ͭ�ڻ������еij������ϼ���+l��+2����֪Cu2O��ϡ���ᷴӦ����Һ����ɫ��
��1����ҵ�Ͽ���Cu2S+O2 2Cu+SO2��Ӧ��ȡ��ͭ������32gCu2S����ʱ������ת����Ŀ�� ��
2Cu+SO2��Ӧ��ȡ��ͭ������32gCu2S����ʱ������ת����Ŀ�� ��
��2��������ͭ˿����������ϡ�����У��¶ȿ�����50�棬����H2O2����Ӧһ��ʱ������µ�60�棬�ٷ�Ӧһ��ʱ�����Ƶ�����ͭ���¶ȿ�����50��-60�������ԭ����˼ӿ췴Ӧ�����⣬���� ����CuSO4��Һ�м���һ������Na2SO3��NaCl��Һ���ȣ�����CuCl����,д������CuCl�����ӷ���ʽ ��
��3��ijС��ͬѧ����ͭ��Ũ���ᷴӦ��ʵ��ʱ������ͭƬ�����к�ɫ�������ɡ�
�ټ�ͬѧ���룺��ɫ������δ���ü��ܽ������CuO, �������û�ѧ����ʽ��ʾΪ��
Cu + H2SO4
����ͬѧ��Ϊ����ɫ�����CuO����ܺ���Cu2S��CuS.�����ɿ����� ������ĸ��
a��Cu2S��CuS���Ǻ�ɫ��
b��ͭ��Ũ�����ڼ��������·�Ӧ�������ܷų�O2
c��Ũ��������������ͭ�ǻ�ԭ����Cu�Ļ��ϼ�������S�Ļ��ϼ��½��ж��ֿ���
��4������Cu��Cu2O��CuO��ɵĻ�����У�����1 L 0.6 mol/L HNO3��Һǡ��ʹ������ܽ⣬ͬʱ�ռ���2240 mL NO���壨��״������Cu2O��ϡ���ᷴӦ�����ӷ���ʽ���������������������������������� �����������������������H2���Ȼ�ԭ�����õ����������Ϊ�������� g����������к�0.1 mol Cu�����û������ϡ�����ַ�Ӧ����������H2SO4�����ʵ���Ϊ���������� ��
��1��1.2NA ��1�֣�
��2��ͬʱ��ֹH2O2�ֽ⣨1�֣�
Cu2++2Cl-+SO32-+H2O CuCl��+ SO42-+2H+��2�֣�
CuCl��+ SO42-+2H+��2�֣�
��3����CuO+SO2��+H2O ��1�֣� ��ac��2�֣�
��4��3 Cu2O +14 H+ + 2 NO3- = 6 Cu2+ + 2 NO�� + 7 H2O ��2�֣�
16��2�֣� 0.1 mol��2�֣�
��������
�����������1��Cu2S+O2 2Cu+SO2��Ӧ�У�Cu�Ļ��ϼ���+1�۽�Ϊ0�ۣ�O�Ļ��ϼ���0�۽�Ϊ-2�ۣ�S�Ļ��ϼ���-2������Ϊ+4�ۣ� 32gCu2S�����ʵ�����0.2mol������0.2molCu2S����ʱ��SԪ�صõ��ĵ��ӵ����ʵ�����0.2mol��(4+2)=1.2mol,����ת�Ƶ�����Ϊ1.2NA��
2Cu+SO2��Ӧ�У�Cu�Ļ��ϼ���+1�۽�Ϊ0�ۣ�O�Ļ��ϼ���0�۽�Ϊ-2�ۣ�S�Ļ��ϼ���-2������Ϊ+4�ۣ� 32gCu2S�����ʵ�����0.2mol������0.2molCu2S����ʱ��SԪ�صõ��ĵ��ӵ����ʵ�����0.2mol��(4+2)=1.2mol,����ת�Ƶ�����Ϊ1.2NA��
��2���¶ȹ��ߣ����������ֽ⣬����Ϊ�˷�ֹ��������ֽ⣬���¶ȿ�����һ����Χ�ڣ���CuSO4��Һ�м���һ������Na2SO3��NaCl��Һ���ȣ�����CuCl����,Cu�Ļ��ϼ۽��ͣ���S�Ļ��ϼ����ߣ����Բ�������������������ɣ����Է�Ӧ�����ӷ���ʽΪCu2++2Cl-+SO32-+H2O CuCl��+ SO42-+2H+��
CuCl��+ SO42-+2H+��
��3����Cu + H2SO4��Ӧ����δ�ܽ������CuO���ɣ��������CuO����������ˮ����ƽ��IJ�����CuO+SO2��+H2O��
�ڸ������ʵ����ʣ�Cu2S��CuSҲ�Ǻ�ɫ�ģ���Ũ��������������ͭ�ǻ�ԭ����Cu�Ļ��ϼ�������S�Ļ��ϼ��½��ж��ֿ��ܣ����Դ�ѡac��
��4��Cu2O��ϡ���ᷴӦ��������ͭ��NO���塢ˮ�����ӷ���ʽΪ3 Cu2O +14 H+ + 2 NO3- = 6 Cu2+ + 2 NO�� + 7 H2O��Cu��Cu2O��CuO��ɵĻ������ϡ���ᷴӦ���յõ�����Һ������ͭ��Һ��2240 mL NO���壨��״���������ʵ�����0.1mol,����NԪ���غ㣬��Cu(NO3)2�����ʵ�����(1L��0.6mol/L-0.1mol)/2=0.25mol������������ԭ�û����õ��Ĺ�����Cu������Cu�����ʵ�����0.25mol,������16g�������ϼ����֪���������CuԪ�ص����ʵ�����0.25mol����CuԪ���غ�ɵã�2��n��Cu2O��+n��CuO��+0.1mol=0.25mol����������ԭ��Ӧ��ʧ�����غ��֪��0.1��2+2��n��Cu2O��=0.1mol��3����֮�ã�n��Cu2O��=0.05mol��n��CuO��=0.05mol��������У�0.1mol Cu����ϡH2SO4��Ӧ��0.05molCu2O��0.05molCuO��ϡH2SO4��Ӧ������Cu2O��CuO����ԭ����H2SO4��Ӧ���H+����H2O���ɵ�n��H2SO4��=0.05mol+0.05mol=0.1mol��
���㣺��������ļ���

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�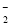 ��3H2O��CO2===2Al(OH)3����CO
��3H2O��CO2===2Al(OH)3����CO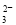
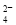 ��ȫ������Al3����Ba2����SO
��ȫ������Al3����Ba2����SO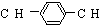 ����M�Ľṹʽ����
����M�Ľṹʽ����  Sb4O6+6FeS��Sb4O6+6C
Sb4O6+6FeS��Sb4O6+6C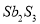 ��
��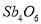

 A��25��ʱ��1.0L pH=13��Ba(OH)2��Һ�к��е�OH����ĿΪ0.2NA
A��25��ʱ��1.0L pH=13��Ba(OH)2��Һ�к��е�OH����ĿΪ0.2NA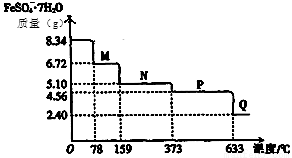
 FeO+SO3��
FeO+SO3��