��Ŀ����
�����£���0.2mol/LAl2(SO4)3����Һ�У���μ���1.0mol/LNaOH��Һ��ʵ������ҺpH��NaOH��Һ����仯��������ͼ�������й�˵����ȷ���ǣ� ��
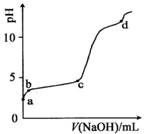
A��a��ʱ����Һ�����Ե�ԭ����Al3+ˮ�⣬���ӷ���ʽΪ��Al3��+3OH- Al(OH)3
Al(OH)3
B��d��ʱ��Al(OH)3������ʼ�ܽ�
C��a-b�Σ���ҺpH����A13+Ũ�Ȳ���
D��b-c�Σ������OH-��Ҫ��������AI(OH)3����
D
��������
��������� a��ʱ����Һ�����Ե�ԭ����Al3+ˮ�⣬����ˮ��������ʣ�����ˮ������ӷ���ʽ��Ӧ��д��ѧʽ�����ӷ���ʽΪ��Al3��+3H2O Al(OH)3+3H+��ѡ��A��������Һ�м���NaOH��Һ�����ȷ���������ӦAl3����3OH-= Al(OH)3�����������������������ܽⷴӦ��Al(OH)3+ OH-= AlO2-+ 2H2O��c��ʱ��Al(OH)3������ʼ�ܽ�,����ѡ��B���� a-b�Σ���ҺpH����A13+Ũ����С��ѡ��C���� b-c�Σ������OH-��Ҫ��������AI(OH)3������ѡ��D��ȷ��
Al(OH)3+3H+��ѡ��A��������Һ�м���NaOH��Һ�����ȷ���������ӦAl3����3OH-= Al(OH)3�����������������������ܽⷴӦ��Al(OH)3+ OH-= AlO2-+ 2H2O��c��ʱ��Al(OH)3������ʼ�ܽ�,����ѡ��B���� a-b�Σ���ҺpH����A13+Ũ����С��ѡ��C���� b-c�Σ������OH-��Ҫ��������AI(OH)3������ѡ��D��ȷ��
���㣺����Al2(SO4)3��NaOH������Ӧ���Ⱥ�˳����Һ��pH�仯����Ũ�ȹ�ϵ��֪ʶ��

��ϰ��ϵ�д�
�����Ŀ


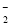 ��3H2O��CO2===2Al(OH)3����CO
��3H2O��CO2===2Al(OH)3����CO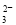
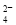 ��ȫ������Al3����Ba2����SO
��ȫ������Al3����Ba2����SO
 ��2OH��===CaCO3����CO
��2OH��===CaCO3����CO ��2H2O
��2H2O ��3Cl����5H2O
��3Cl����5H2O