题目内容
12.将一定质量的苯完全燃烧,放出的热量为Q,生成的CO2恰好被500mL,1mol/L NaOH溶液吸收生成酸式盐,则同样条件下完全燃烧1mol苯放出的热量是( )| A. | 12Q | B. | 10Q | C. | 8Q | D. | 6Q |
分析 生成酸式盐为碳酸氢钠,根据CO2与NaOH溶液反应关系式CO2~NaOH计算出CO2的物质的量,进而计算出苯的物质的量,根据苯的物质的量和热量的关系计算出完全燃烧1mol苯放出的热量.
解答 解:500mL 1mol/L的NaOH溶液中含:n(NaOH)=0.5L×1mol/L=0.5mol,CO2与NaOH溶液反应生成的酸式盐为碳酸氢钠,反应方程式为:NaOH+CO2═NaHCO3,则由关系式CO2~NaOH可知:n(CO2)=0.5mol,
则n(C6H6)=$\frac{1}{6}$×n(CO2)=0.5mol×$\frac{1}{6}$=$\frac{1}{12}$mol,即$\frac{1}{12}$mol苯完全燃烧放出的热量为Q,
所以1mol苯完全燃烧放出的热量为:$\frac{QkJ}{\frac{1}{12}}$=12Q,
故选A.
点评 本题考查反应热的计算,题目难度不大,根据生成二氧化碳的物质的量计算苯的物质的量是解答该题的关键,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案
相关题目
3.已知a、b两种脂肪烃的结构简式如图所示.下列说法中不正确的是( )
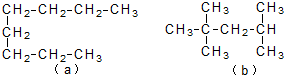
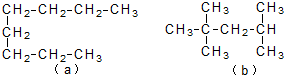
| A. | a和b都不能使酸性KMnO4溶液褪色 | |
| B. | a和b分子中的所有碳碳单键间的键角都相同 | |
| C. | a的沸点比b高 | |
| D. | b脱氢可以形成3种单烯烃分子 |
17.下列有关有机物的说法正确的是( )
| A. | (NH4)2SO4溶液能使蛋白质变性 | |
| B. | 分子式为C2H4O2的有机物不一定是羧酸 | |
| C. | 煤的干馏是物理变化,煤的气化和液化是化学变化 | |
| D. | 纤维素、蛋白质、油脂、葡萄糖在一定条件下都能发生水解反应 |
4.下列实验能达到目的是( )
| A. | 用湿润的蓝色石蕊试纸检验氨气 | |
| B. | 某溶液加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+ | |
| C. | NaCl溶液蒸发结晶时,蒸发皿中有晶体析出并剩余少量液体即停止加热 | |
| D. | 将混有HCl的Cl2通入饱和NaHCO3溶液中除去HCl |
2.下列说法正确的是( )
| A. | 在设计化工生产的化学反应条件时,只要将化学反应的特点和化学反应理论相结合进行全面分析就没问题了 | |
| B. | 在设计化工生产的化学反应条件时,若化学反应的速率很高,就不需要考虑催化剂的问题 | |
| C. | 在现代,工业的将SO2氧化为SO3的适宜条件是高温、高压和催化剂 | |
| D. | 在2SO2+O2$?_{450}^{V_{2}O_{5}}$2SO3中,对“450°C”的选择,来自对反应物性质和催化剂性质的综合考虑 |
 ,该微粒是元素周期表中的氧元素,它的核电荷数是8,碳元素的核电荷数是6,由此可知不同元素的本质区别是质子数不同.
,该微粒是元素周期表中的氧元素,它的核电荷数是8,碳元素的核电荷数是6,由此可知不同元素的本质区别是质子数不同.