题目内容
20.已知8gA和10gB恰好完全反应生成0.02mol C和15.88g D,则C的摩尔质量为106g•mol-1.分析 先根据质量守恒计算C的质量,再根据M=$\frac{m}{n}$计算其摩尔质量
解答 解:8gA和10g克B恰好完全反应生成0.02molC和15.88gD,根据质量守恒知,C的质量=8g+10g-15.88g=2.12g,C的摩尔质量=$\frac{m}{n}$=$\frac{2.12g}{0.02mol}$=106g/mol;
故答案为:106 g•mol-1
点评 本题考查了有关摩尔质量的计算,会熟练利用质量守恒定律和公式M=$\frac{m}{n}$解题是关键,难度不大.

练习册系列答案
相关题目
9.X、Y为短周期元素,X的最高价氧化物对应的水化物是难溶碱.Y元素的原子次外层电子数为2;它的最高价氧化物对应的水化物为强酸;X的单质在Y中燃烧生成的化合物的电子数为( )
| A. | 19 | B. | 30 | C. | 45 | D. | 50 |
11.下列选项中所涉及到的两个量一定不相等的是( )
| A. | 足量的钠在等物质的量的Cl2和O2中分别燃烧转移电子数 | |
| B. | 等物质的量的KO2与CaO2分别与水反应生成O2的体积(相同条件下) | |
| C. | 100mL 1mol/L HNO3分别与1.4g Fe、2.8gFe完全反应时生成 的NO物质的量 | |
| D. | 等浓度等体积的盐酸、NaOH溶液分别与一定量Al反应生成等质量气体时转移的电子数 |
8.为了消除氮的氧化物(NOx)对大气的污染,工业上通常利用反应NOx+NH3→N2+H2O来保护环境,现有NO2和NO的混合气体3L,可用3.5L NH3恰好使其完全转化为N2,则混和气体中NO2和NO的气体体积之比为( )
| A. | 1:4 | B. | 1:1 | C. | 2:1 | D. | 3:1 |
15.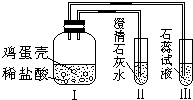 某同学做“证明鸡蛋壳的主要成分是碳酸盐”的实验时,设计了如图所示的方案.经检验装置气密性合格并加入试剂.下列说法中不正确的是( )
某同学做“证明鸡蛋壳的主要成分是碳酸盐”的实验时,设计了如图所示的方案.经检验装置气密性合格并加入试剂.下列说法中不正确的是( )
 某同学做“证明鸡蛋壳的主要成分是碳酸盐”的实验时,设计了如图所示的方案.经检验装置气密性合格并加入试剂.下列说法中不正确的是( )
某同学做“证明鸡蛋壳的主要成分是碳酸盐”的实验时,设计了如图所示的方案.经检验装置气密性合格并加入试剂.下列说法中不正确的是( )| A. | 鸡蛋壳发生了分解反应 | |
| B. | Ⅰ中发生的现象为鸡蛋壳逐渐溶解,产生大量气泡 | |
| C. | II中的澄清石灰水变浑浊 | |
| D. | III中紫色石蕊试液变红 |
12.将一定质量的苯完全燃烧,放出的热量为Q,生成的CO2恰好被500mL,1mol/L NaOH溶液吸收生成酸式盐,则同样条件下完全燃烧1mol苯放出的热量是( )
| A. | 12Q | B. | 10Q | C. | 8Q | D. | 6Q |
9.已知26%氨水的密度约为0.91g•cm-3,6%氨水的密度约为0.98g•cm-3若将上述两溶液等体积混合,所得氨水溶液的质量分数是( )
| A. | 等于16% | B. | 大于16% | C. | 小于16% | D. | 无法估算 |
10.下列过程的△H<0的是( )
| A. | Ba(OH)2•8H2O晶体和NH4Cl晶体混合反应 | |
| B. | 煅烧石灰石 | |
| C. | CH3COOH?CH3COO-+H+ | |
| D. | 生石灰溶于水 |

 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$ 
 (R为-CH3或-H)
(R为-CH3或-H) $\stackrel{MnO_{2}/H_{2}SO_{4}}{→}$
$\stackrel{MnO_{2}/H_{2}SO_{4}}{→}$
 生成A的反应类型是取代反应.
生成A的反应类型是取代反应.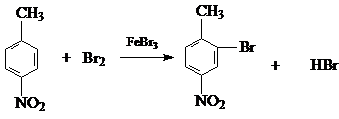 .
.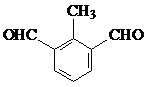 或
或 (任写一种即可)
(任写一种即可)