题目内容
两种位于不同短周期元素X、Y,其原子序数相差4,X的基态原子的价电子层排布为 ns1,Y的基态原子的价电子层排布为 ns2np3,它们能形成两种化合物X3Y和XY3.
(1)画出Y原子的电子排布图(轨道表示式): .
(2)请用“>”或“<”比较原子半径或离子半径的大小:r(X) r(Y)、r(X+) r(Y3-).
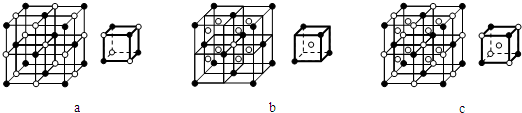
(3)下列各图中,可能是X3Y晶体晶胞的是 (“○”表示阳离子,“●”表示阴离子,大图表示晶胞,小图表示晶胞的
).
(4)XY3中的阴离子与CO2是等电子体,则该阴离子的空间构型是 .
(1)画出Y原子的电子排布图(轨道表示式):
(2)请用“>”或“<”比较原子半径或离子半径的大小:r(X)
(3)下列各图中,可能是X3Y晶体晶胞的是
| 1 |
| 8 |

(4)XY3中的阴离子与CO2是等电子体,则该阴离子的空间构型是
考点:原子核外电子排布,微粒半径大小的比较,判断简单分子或离子的构型,晶胞的计算
专题:原子组成与结构专题,化学键与晶体结构
分析:从L层开始出现p能级,所以短周期元素n=2或3,因此X可能是Li或Na,Y可能是N或P,两种位于不同短周期元素且原子序数相差4,因此确定X为Na,Y为N.
(1)N核外电子数为7,电子排布式为1s2 2s22p3,结合泡利原理和洪特规则书写电子排布图;
(2)同一周期从左到右,原子半径逐渐减小,同主族自上而下,原子半径逐渐增大,核外电子排布相同时,质子数越大,半径越小;
(3)X3Y晶体为Na3N晶体,阳离子与阴离子比为3:1,根据小图表示晶胞的
按照均摊法判断离子个数比;
(4)等电子体具有相同的空间构型,根据二氧化碳的空间构型即可得到Na3N中的阴离子的空间构性.
(1)N核外电子数为7,电子排布式为1s2 2s22p3,结合泡利原理和洪特规则书写电子排布图;
(2)同一周期从左到右,原子半径逐渐减小,同主族自上而下,原子半径逐渐增大,核外电子排布相同时,质子数越大,半径越小;
(3)X3Y晶体为Na3N晶体,阳离子与阴离子比为3:1,根据小图表示晶胞的
| 1 |
| 8 |
(4)等电子体具有相同的空间构型,根据二氧化碳的空间构型即可得到Na3N中的阴离子的空间构性.
解答:
解:从L层开始出现p能级,所以短周期元素n=2或3,因此X可能是Li或Na,Y可能是N或P,两种位于不同短周期元素且原子序数相差4,因此确定X为Na,Y为N.
(1)N核外电子数为7,电子排布式为1s2 2s22p3,结合泡利原理和洪特规,电子排布图为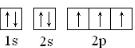 ,
,
故答案为: ;
;
(2)同一周期从左到右,原子半径逐渐减小,因此Li的原子半径大于N的原子半径,同主族自上而下,原子半径逐渐增大,因此Li的原子半径小于Na的原子半径,所以Na的原子半径大于N的原子半径;钠离子和氮离子具有相同的核外电子排布,钠离子的质子数多,所以半径较小,
故答案为:>;<;(3)X3Y晶体为Na3N晶体,阳离子与阴离子比为3:1,
a、小图钠离子与氮离子个数比为4×
:4×
=1:1,故a错误;
b、小图钠离子与氮离子个数比为1×1:4×
=2:1,故b错误;
C、小图钠离子与氮离子个数比为(1×1+4×
):4×
=3:1,故c正确;
故答案为:c;
(4)二氧化碳的结构式为O=C=O,碳原子采取sp杂化,空间构型为直线形,因此Na3N中的阴离子的空间构型为直线形,
故答案为:直线形.
(1)N核外电子数为7,电子排布式为1s2 2s22p3,结合泡利原理和洪特规,电子排布图为
 ,
,故答案为:
 ;
;(2)同一周期从左到右,原子半径逐渐减小,因此Li的原子半径大于N的原子半径,同主族自上而下,原子半径逐渐增大,因此Li的原子半径小于Na的原子半径,所以Na的原子半径大于N的原子半径;钠离子和氮离子具有相同的核外电子排布,钠离子的质子数多,所以半径较小,
故答案为:>;<;(3)X3Y晶体为Na3N晶体,阳离子与阴离子比为3:1,
a、小图钠离子与氮离子个数比为4×
| 1 |
| 8 |
| 1 |
| 8 |
b、小图钠离子与氮离子个数比为1×1:4×
| 1 |
| 8 |
C、小图钠离子与氮离子个数比为(1×1+4×
| 1 |
| 8 |
| 1 |
| 8 |
故答案为:c;
(4)二氧化碳的结构式为O=C=O,碳原子采取sp杂化,空间构型为直线形,因此Na3N中的阴离子的空间构型为直线形,
故答案为:直线形.
点评:本题考查了原子结构和性质,涉及核外电子排布式(图)的书写、微粒半径大小比较,均摊法计算晶胞离子比、等电子体的性质和分子的空间构型等,综合性较强,符合高考多点考查的特点,注意培养相关解题方法、化学原理的积累和应用能力.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案
相关题目
下列分子中的中心原子的杂化方式为sp杂化,分子的空间结构为直线形且分子中有2个π键的是( )
| A、CH2=CH2 |
| B、CO2 |
| C、H2 |
| D、BF3 |
用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、标准状况下,22.4L酒精含有的分子数为 NA |
| B、常温常压下,1.06g Na2CO3含有的Na+离子数为0.01 NA |
| C、11.2 L H2所含的电子数为NA |
| D、通常状况下,NA个CO2分子含有原子数为3 NA |
某基态原子第四电子层只有1个电子,该原子的第三电子层电子数可能有( )
| A、13 | B、16 |
| C、8~18 | D、18~32 |
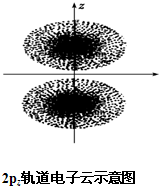 如图是2pz轨道电子云的示意图,请观察图,并判断下列说法中不正确的是( )
如图是2pz轨道电子云的示意图,请观察图,并判断下列说法中不正确的是( )| A、2pz轨道上的电子在空间出现的概率分布是z轴对称 |
| B、点密集的地方表明电子出现的机会多 |
| C、电子先沿z轴正半轴运动,然后在负半轴运动 |
| D、2pz轨道形状为两个椭圆球 |
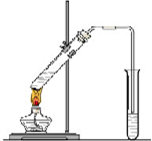 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用图所示的装置制取乙酸乙酯.回答下列问题
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用图所示的装置制取乙酸乙酯.回答下列问题