题目内容
15.下列有关醛的判断正确的是( )| A. | 用溴水检验CH2═CH-CHO中是否含有碳碳双键 | |
| B. | 1 mol HCHO发生银镜反应最多生成2 mol Ag | |
| C. | 对甲基苯甲醛( )使酸性高锰酸钾溶液褪色,说明它含有醛基 )使酸性高锰酸钾溶液褪色,说明它含有醛基 | |
| D. | 能发生银镜反应的有机物不一定是醛类 |
分析 A.碳碳双键、-CHO均与溴水反应;
B.1 mol HCHO含2mol-CHO;
C.甲基、-CHO均能被高锰酸钾氧化;
D.含-CHO的有机物均可发生银镜反应.
解答 解:A.碳碳双键、-CHO均与溴水反应,则用溴水不能检验CH2═CH-CHO中是否含有碳碳双键,故A错误;
B.1 mol HCHO含2mol-CHO,则1 mol HCHO发生银镜反应最多生成4 mol Ag,故B错误;
C.甲基、-CHO均能被高锰酸钾氧化,则使酸性高锰酸钾溶液褪色,不能说明它含有醛基,故C错误;
D.含-CHO的有机物均可发生银镜反应,如醛、葡萄糖、HCOOH、甲酸某酯等均可发生银镜反应,则能发生银镜反应的有机物不一定是醛类,故D正确;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力及有机物官能团检验的考查,题目难度不大.

练习册系列答案
相关题目
5.某无色混合气体,可能含有CO、H2、SO2、Cl2、HCl中的一种或几种,把此混合气体通过NaOH溶液,无明显现象;再通过红热的CuO粉末,粉末变成红色;最后通入AgNO3溶液中,无沉淀生成,则下列关于此混合气体的叙述正确的是( )
| A. | CO和H2中至少有一种 | B. | 肯定没有Cl2和HCl | ||
| C. | 肯定有SO2 | D. | 不能确定有无Cl2、HCl、SO2 |
6.下列电子式书写正确的有( )
| A. | 氮分子  | B. | 过氧化氢  | C. | Na2O  | D. | 氯气 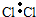 |
3.下列物质中不含非极性共价键的是( )
①Na2O2 ②CH4 ③FeS2 ④NH4Cl ⑤H-O-O-H ⑥Ca(OH)2.
①Na2O2 ②CH4 ③FeS2 ④NH4Cl ⑤H-O-O-H ⑥Ca(OH)2.
| A. | ①②③④ | B. | ④⑤⑥ | C. | ②④⑥ | D. | ②③⑤ |
20.某烃的一种同分异构体只能生成一种一氯代物,该烃的分子式可以是( )
| A. | C2H6 | B. | C3H8 | C. | C4H10 | D. | C5H12 |
7.根据原子结构及元素周期律的知识,下列推断正确的是( )
| A. | 同周期元素含氧酸的酸性随核电荷数的增加而增强 | |
| B. | 核外电子排布相同的微粒化学性质也相同 | |
| C. | Cl?、S2?、K+、Ca2+半径逐渐减小 | |
| D. | ${\;}_{17}^{35}$Cl与${\;}_{17}^{37}$Cl得电子能力相同 |
4.图是元素周期表的一部分,其中A、B、C为短周期主族元素,下列说法正确的是( )
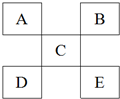

| A. | 如果D是金属元素,那么D元素的金属性比C强 | |
| B. | 元素C的最高价氧化物对应的水化物一定是强酸 | |
| C. | 元素B与氢形成的化合物中只能存在极性共价键 | |
| D. | 若E为非金属,则E的非金属性要强于B |

 .
.