题目内容
5.某无色混合气体,可能含有CO、H2、SO2、Cl2、HCl中的一种或几种,把此混合气体通过NaOH溶液,无明显现象;再通过红热的CuO粉末,粉末变成红色;最后通入AgNO3溶液中,无沉淀生成,则下列关于此混合气体的叙述正确的是( )| A. | CO和H2中至少有一种 | B. | 肯定没有Cl2和HCl | ||
| C. | 肯定有SO2 | D. | 不能确定有无Cl2、HCl、SO2 |
分析 根据是无色的混合气体,可知有色气体不存在;通过NaOH溶液,会将酸性气体吸收掉;再通过红热的CuO粉末,粉末变成红色,说明有还原性气体;通往AgNO3溶液中,无沉淀生成,说明通入AgNO3溶液的气体中无HCl,据此分析.
解答 解:由于是无色的混合气体,可知有色气体Cl2不存在,通过NaOH溶液无明显现象,说明可能存在的SO2、HCl酸性气体吸收掉;再通过红热的CuO粉末,粉末变成红色,说明有还原性气体CO或H2;通往AgNO3溶液中,无沉淀生成,说明通入AgNO3溶液的气体中无HCl,但由于HCl可能是被NaOH吸收掉的,故HCl是否存在不能确定.
故气体中一定无Cl2,一定有CO和H2或两者中的一种,SO2和HCl的存在不能确定.
故选A.
点评 本题考查了混合气体成分的检验,应注意的是通入AgNO3溶液后无沉淀生成,说明气体中无HCl,但由于HCl可能是被NaOH吸收掉的,故HCl是否存在不能确定.,题目难度中等

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.下列化学用语对应正确的是( )
| A. | NH4Cl的电子式: | B. | 甲烷的结构式: | C. | H2O2的电子式: | D. | CCl4的电子式: |
13.化学在生产和日常生活中有着重要的应用.下列说法不正确的是( )
| A. | 明矾水解形成的Al(OH)3胶体能吸附水中的悬浮物,可用于水的净化 | |
| B. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 | |
| C. | 2NO(g)+2CO(g)=N2(g)+2CO2(g) 在常温下能自发进行,则该反应的△H<0 | |
| D. | 电解MgCl2饱和溶液,可制得金属镁 |
17.有关图中化合物的说法错误的是( )


| A. | 该化合物与Br2能发生加成反应和取代反应 | |
| B. | 1 mol该化合物与NaOH溶液反应时最多消耗3 mol NaOH | |
| C. | 该化合物能使酸性高锰酸钾溶液褪色 | |
| D. | 该化合物能和Na2CO3溶液反应放出CO2 |
14.下表是元素周期表中的一部分:
根据A~I在周期表中的位置,用元素符号或化学式回答下列问题:
(1)表中元素,化学性质最不活泼的是Ne,只有负价而无正价的是F,氧化性最强的单质是F2,还原性最强的单质是Na.
(2)A分别与D、E、F、G、H形成的化合物中显碱性的是NH3,最稳定的是HF.
(3)在B、C、D、E、F、G、H中,原子半径最大的是Na.
(4)B、C、H三种元素的最高价氧化物对应水化物两两间反应的化学方程式分别为:Al(OH)3+NaOH=NaAlO2+2H2O;H2SO4+2NaOH=Na2SO4+2H2O;2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
(1)表中元素,化学性质最不活泼的是Ne,只有负价而无正价的是F,氧化性最强的单质是F2,还原性最强的单质是Na.
(2)A分别与D、E、F、G、H形成的化合物中显碱性的是NH3,最稳定的是HF.
(3)在B、C、D、E、F、G、H中,原子半径最大的是Na.
(4)B、C、H三种元素的最高价氧化物对应水化物两两间反应的化学方程式分别为:Al(OH)3+NaOH=NaAlO2+2H2O;H2SO4+2NaOH=Na2SO4+2H2O;2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O.
15.下列有关醛的判断正确的是( )
| A. | 用溴水检验CH2═CH-CHO中是否含有碳碳双键 | |
| B. | 1 mol HCHO发生银镜反应最多生成2 mol Ag | |
| C. | 对甲基苯甲醛( )使酸性高锰酸钾溶液褪色,说明它含有醛基 )使酸性高锰酸钾溶液褪色,说明它含有醛基 | |
| D. | 能发生银镜反应的有机物不一定是醛类 |
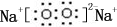 ,0.10mol该化合物与足量水反应时转移的电子数为6.02×1022.
,0.10mol该化合物与足量水反应时转移的电子数为6.02×1022.