题目内容
7.根据原子结构及元素周期律的知识,下列推断正确的是( )| A. | 同周期元素含氧酸的酸性随核电荷数的增加而增强 | |
| B. | 核外电子排布相同的微粒化学性质也相同 | |
| C. | Cl?、S2?、K+、Ca2+半径逐渐减小 | |
| D. | ${\;}_{17}^{35}$Cl与${\;}_{17}^{37}$Cl得电子能力相同 |
分析 A.应是“同周期元素最高价含氧酸的酸性随核电荷数的增加而增强”;
B.核外电子排布相同的微粒化学性质不一定相同,如S2-、Ar、K+;
C.电子层结构相同的离子,核电荷数越大离子半径越小;
D.3517Cl与3717Cl互为同位素,化学性质相同.
解答 解:A.应是“同周期元素最高价含氧酸的酸性随核电荷数的增加而增强”,不是最高价含氧酸则不一定,如硫酸为强酸,HClO为弱酸,故A错误;
B.核外电子排布相同的微粒化学性质不一定相同,如S2-、Ar、K+,但互为同位素原子时化学性质相同,故B错误;
C.电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:S2?>Cl?>K+>Ca2+,故C错误;
D.3517Cl与3717Cl互为同位素,化学性质相同,得电子能力相同,故D正确.
故选:D.
点评 本题考查元素周期律应用、微粒半径比较、同位素等、原子构成与性质等,A为易错点,学生容易忽略最高价含氧酸.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
17.有关图中化合物的说法错误的是( )


| A. | 该化合物与Br2能发生加成反应和取代反应 | |
| B. | 1 mol该化合物与NaOH溶液反应时最多消耗3 mol NaOH | |
| C. | 该化合物能使酸性高锰酸钾溶液褪色 | |
| D. | 该化合物能和Na2CO3溶液反应放出CO2 |
18.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 室温下,21.0 g乙烯与丙烯的混合气体中含有的碳原子数为1.5 NA | |
| B. | 常温常压下,0.1molC8H18所含有的共价键数目为2.0 NA | |
| C. | 0.1mol乙醇与氧气完全反应生成二氧化碳时转移电子数为0.1NA | |
| D. | 标准状况下,2.24L乙酸乙酯中所含氧原子数为0.2NA |
15.下列有关醛的判断正确的是( )
| A. | 用溴水检验CH2═CH-CHO中是否含有碳碳双键 | |
| B. | 1 mol HCHO发生银镜反应最多生成2 mol Ag | |
| C. | 对甲基苯甲醛( )使酸性高锰酸钾溶液褪色,说明它含有醛基 )使酸性高锰酸钾溶液褪色,说明它含有醛基 | |
| D. | 能发生银镜反应的有机物不一定是醛类 |
12.下列有关化学用语正确的是( )
①乙烯的最简式:C2H4
②乙醇的结构简式:C2H6O
③乙烷的结构式:CH3CH3
④四氯化碳的电子式: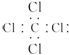
⑤乙醛的结构简式:CH3COH.
①乙烯的最简式:C2H4
②乙醇的结构简式:C2H6O
③乙烷的结构式:CH3CH3
④四氯化碳的电子式:
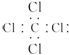
⑤乙醛的结构简式:CH3COH.
| A. | 全对 | B. | 全错 | C. | ③④ | D. | ①⑥ |
16.实验室制备1,2-二溴乙烷的反应原理如下:
CH3CH2OH$\stackrel{H_{2}SO_{4}}{→}$CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸存在下在140℃脱水生成乙醚.
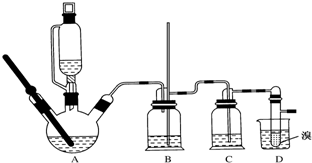
用少量溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:
有关数据列表如下:
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是减少副产物乙醚生成;
(2)在装置C中应加入d,其目的是吸收反应中可能生成的酸性气体 (填正确选项前的字);
a.水 b.浓硫酸 c.饱和碳酸氢钠溶液 d.氢氧化钠溶液
(3)判断该制备反应已经结束的最简单方法是溴的颜色完全褪去;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”“下”).
(5)若产物中有少量未反应的Br2,最好用c洗涤除去;(填正确选项前的字母)
a.水 b.碘化钠溶液 c.氢氧化钠溶液 d.乙醇.
CH3CH2OH$\stackrel{H_{2}SO_{4}}{→}$CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸存在下在140℃脱水生成乙醚.
用少量溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:

有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状 态 | 无 色 液 体 | 无 色 液 体 | 无 色 液 体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是减少副产物乙醚生成;
(2)在装置C中应加入d,其目的是吸收反应中可能生成的酸性气体 (填正确选项前的字);
a.水 b.浓硫酸 c.饱和碳酸氢钠溶液 d.氢氧化钠溶液
(3)判断该制备反应已经结束的最简单方法是溴的颜色完全褪去;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”“下”).
(5)若产物中有少量未反应的Br2,最好用c洗涤除去;(填正确选项前的字母)
a.水 b.碘化钠溶液 c.氢氧化钠溶液 d.乙醇.
17.下列电子式中错误的是( )
| A. | Na+ | B. |  | C. |  | D. |  |