题目内容
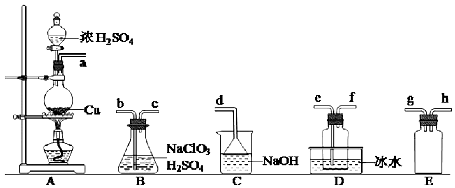
17.二氧化氯(ClO2)是极易溶于水且不与水发生化学反应的黄绿色气体,沸点为11℃.某小组在实验室中拟用图所示装置制取并收集C1O2.冋答下列问题:(1)C1O2的制备
已知:SO2+2NaClO3+H2SO4═2C1O2↑+2NaHSO4
①装置A中反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
②欲收集干燥的C1O2,选择图中的装罝,其连接顺序为a→g→h→b→c→e→f→d(按气流方向,用小写字母表示).
③装置D的作用是冷凝并收集ClO2.
④若没有E装置,会造成的严重后果是B中的溶液会倒吸进入A中,造成烧瓶炸裂.
(2)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液.为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10.00mL,稀释成100.00mL试样;量取V1mL试样加入到锥形瓶中;
步骤2:调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入淀粉指示剂,用c mol/LNa2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL.(已知2Na2S2O3+I2=Na2S4O6+2NaI)
①步骤2的反应中氧化产物的电子式为
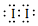 .
.②滴定终点的实验现象是溶液恰好由蓝色变无色,并保持30s不变.
③原C1O2溶液的浓度为$\frac{135c{V}_{2}}{{V}_{1}}$g/L(用少骤中的字母代数式表示).
④若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果偏高;若滴定开始仰视读数,滴定终点时正确读数,则测定结果偏低.(填“偏高”“偏低”或“不变”).
分析 (1)ClO2 的制备:装置A中又Cu与浓硫酸发生反应制备二氧化硫气体,在装置B中发生生成二氧化氯的反应,为防止倒吸,A与B之间连接装置E,二氧化氯沸点较低,故在D中冰水浴收集,最后用氢氧化钠吸收未反应完的二氧化硫,防止污染空气,据此分析解答;
(2)①步骤2中的氧化产物为碘,据此书写;
②碘反应完毕,加入最后一滴Na2S2O3溶液,溶液蓝色褪去;
③根据关系式2ClO2~5I2~10Na2S2O3计算c(ClO2);
④根据实验操作中滴定液体积大小的影响来回答判断.
解答 解:(1)①装置 A 中反应Cu与浓硫酸制备二氧化硫,化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+H2O;
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
②二氧化硫从a进入装置B中反应,为防止倒吸,故应在之前有安全瓶,则a→g→h,为反应充分,故再连接B装置中的b,二氧化氯沸点较低,故在D中冰水浴收集,为充分冷却,便于收集,故连接e,最后用氢氧化钠吸收未反应完的二氧化硫,防止污染空气,连接顺序为:a→g→h→b→c→e→f→d;
故答案为:g→h→b→c→e→f→d;
③装置D的作用为冷凝并收集ClO2;
故答案为:冷凝并收集ClO2;
④若无装置E,B中的溶液会倒吸进入A中,造成烧瓶炸裂;
故答案为:B中的溶液会倒吸进入A中,造成烧瓶炸裂;
(2)①二氧化氯具有氧化性,在酸性环境下,能将碘离子氧化,反应的原理方程式为:2ClO2+10I-+8H+=2Cl-+5I2+4H2O,氧化产物为碘,电子式为: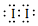 ;
;
故答案为: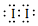 ;
;
②碘反应完毕,加入最后一滴Na2S2O3溶液,溶液蓝色变为无色,且30s内不变色,说明反应到达终点;
故答案为:溶液恰好由蓝色变无色,并保持30s不变;
③设原ClO2溶液的浓度为x,
2ClO2 ~5I2 ~10Na2S2O3
2mol 10mol
$\frac{0.01x×{V}_{1}×1{0}^{-3}}{0.1}$ 1×10-3cV2mol
x=$\frac{2c{V}_{2}}{{V}_{1}}$mol/L=$\frac{135c{V}_{2}}{{V}_{1}}$g/L,
故答案为:$\frac{135c{V}_{2}}{{V}_{1}}$;
④若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则相当于消耗的滴定液的体积偏大,所以测定结果偏大;若滴定开始仰视读数,滴定终点时正确读数,相当于消耗的滴定液体积偏小,所以结果偏小;
故答案为:偏高;偏低.
点评 本题考查实验方案的设计,题目难度较大,明确物质的性质是解本题关键,试题侧重考查学生分析问题、解决问题的能力,注意掌握化学实验基本操作方法及中和滴定原理.

 智慧小复习系列答案
智慧小复习系列答案 (异丙烯苯)$→_{一定条件}^{H+}$
(异丙烯苯)$→_{一定条件}^{H+}$ (异丙苯),下列说法错误的是( )
(异丙苯),下列说法错误的是( )| A. | 异丙苯的化学式为C9H12 | |
| B. | 该反应属于加成反应 | |
| C. | 异丙苯的一氯代物有5种 | |
| D. | 可用酸性KMnO4,溶液鉴别异丙烯苯和异丙苯 |
| A. | Ca(ClO)2 | B. | CaCl2 | C. | CaCO3 | D. | Ca(OH)2 |
 常用作合成中间体.下列有关该有机物的叙述中正确的是( )
常用作合成中间体.下列有关该有机物的叙述中正确的是( )| A. | 可由丙烯与Cl2发生加成反应制得 | B. | 分子式为 C5H10Cl2 | ||
| C. | 还有3种同分异构体 | D. | 分子中所有碳原子不可能共平面 |
| A. | 80℃时,1L pH=1的硫酸溶液中,含有的OH-数目为10-13NA | |
| B. | 含0.1mol NH4HSO4的溶液中,阳离子数目略小于0.2NA | |
| C. | C3H8分子中的2个H原子分别被1个-NH3和1个-OH取代,1mol此有机物所含共同电子对数目为13NA | |
| D. | 以Mg、Al为电极,NaOH溶液为电解质溶液的原电池中,导线上流过NA个电子 |
| A. | c(I-)=0.1mol/L 的溶液中:K+、Na+、SO42-、ClO- | |
| B. | 常温下,通入SO2气体的溶液中:Al3+、Ca2+、MnO4-、Cl- | |
| C. | 控制pH为9-10,用NaClO溶液将含NaCN废水中的CN-氧化为两种无污染的气体:2CN-+5ClO-+H2O═N2↑+2CO2↑+5Cl-+2OH- | |
| D. | 向含有Ba2+、Cl-、HCO3-的离子组中加入少量的NaOH溶液:HCO3-+OH-═CO32-+H2O |

| A. | HCO3- | B. | NH4+ | C. | A13+ | D. | Mg2+ |
 京剧脸谱是中国戏曲特有的化妆艺术,具有很强的表现力和艺术价值.如图为窦尔敦京剧脸谱,若要将脸谱嘴唇部位涂成红色,则下列各组溶液中可达到该效果的是( )
京剧脸谱是中国戏曲特有的化妆艺术,具有很强的表现力和艺术价值.如图为窦尔敦京剧脸谱,若要将脸谱嘴唇部位涂成红色,则下列各组溶液中可达到该效果的是( )| A. | 氨水和石蕊溶液 | B. | 碘水和淀粉溶液 | ||
| C. | CuCl2溶液和NaOH溶液 | D. | FeCl3溶液和KSCN溶液 |
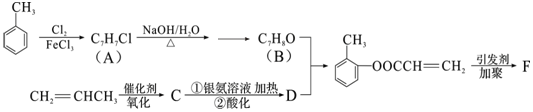
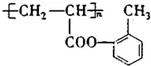
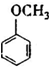 (填结构简式).
(填结构简式).