题目内容
6.0.1mol/L的NaHSO3溶液中,c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),c(HSO3-)+c(SO32-)+c(H2SO3)=c(Na+)=0.1mol/L.分析 0.1mol/L的NaHSO3溶液中存在电荷,溶液中阴阳离子所带电荷数相同,溶液中存在物料守恒,即元素守恒n(Na)=n(S),硫元素所有存在形式微粒浓度之和等于钠离子浓度;
解答 解:NaHSO3溶液中,存在电荷守恒,为c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-),
由物料守恒可知,c(HSO3-)+c(SO32-)+c(H2SO3)=c(Na+)=0.1mol/L,
故答案为:c(HSO3-)+2c(SO32-)+c(OH-),c(Na+)=0.1mol/L.
点评 本题考查离子浓度关系分析,为高考常见题型和高频考点,侧重于学生的分析能力和计算能力的考查,注意把握离子浓度比较的角度,结合电荷守恒和物料守恒解答该题,题目较简单.

练习册系列答案
相关题目
7.下列实验装置(部分仪器已省略)或操作,能达到相应实验目的是( )
| A. |  干燥氯气 | B. |  分离乙醇和水 | C. |  闻气体气味 | D. |  进行喷泉实验 |
8.下列分离与提纯的方法不正确的是( )
| A. | 用蒸发、冷却结晶和过滤的方法从氯化钠和硝酸钾的混合溶液中离出硝酸钾 | |
| B. | 用分液的方法分离乙酸乙酯的饱和碳酸钠溶液 | |
| C. | 用加热的方法提纯含有少量碳酸氢钠的碳酸钠 | |
| D. | 用加水溶解、过滤的方法提含有硫酸钠的碳酸钙 |
14.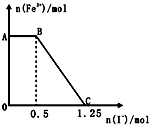 已知酸性高锰酸钾溶液可以将FeSO4氧化,化学反应的方程式为:2KMnO4+10FeSO4+8H2SO4═K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的 物质的量的变化关系如图所示,则下列有关说法不正确的是( )
已知酸性高锰酸钾溶液可以将FeSO4氧化,化学反应的方程式为:2KMnO4+10FeSO4+8H2SO4═K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的 物质的量的变化关系如图所示,则下列有关说法不正确的是( )
 已知酸性高锰酸钾溶液可以将FeSO4氧化,化学反应的方程式为:2KMnO4+10FeSO4+8H2SO4═K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的 物质的量的变化关系如图所示,则下列有关说法不正确的是( )
已知酸性高锰酸钾溶液可以将FeSO4氧化,化学反应的方程式为:2KMnO4+10FeSO4+8H2SO4═K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的 物质的量的变化关系如图所示,则下列有关说法不正确的是( )| A. | 图中AB段主要是高锰酸钾和碘化钾溶液反应 | |
| B. | 图中BC段发生的反应为2Fe3++2I-═2Fe2++I2 | |
| C. | 根据OC段的数据可知开始加入的高锰酸钾的物质的量为0.25mol | |
| D. | 向C点以后的溶液中加入少量KSCN溶液,溶液变红色 |
11.能正确表示下列反应的离子方程式( )
| A. | 碳酸氢铵溶液和足量氢氧化钠溶液混合:HCO3-+OH-═CO32-+H2O | |
| B. | 在氯化亚铁溶液中加入稀硝酸:3Fe2++4H++O3-═3Fe3++NO↑+2H2O | |
| C. | 硝酸银溶液中加入铜粉:Cu+Ag+═Cu2++Ag | |
| D. | 常温下,浓硝酸与铁屑混合:2Fe+6H+═2Fe3++3H2↑ |
18.下列有关NaHCO3与Na2CO3的说法中,正确的是( )
| A. | 分别加热两种样品,没有残留物质是NaHCO3 | |
| B. | 分别配成溶液,再加入澄清石灰水,无白色沉淀生成的是NaHCO3 | |
| C. | 分别与相同物质的量浓度的盐酸反应,产生CO2的速率Na2CO3>NaHCO3 | |
| D. | 常温时在水中的溶解度:Na2CO3>NaHCO3 |
15.下列关于热化学反应的描述中正确的是( )
| A. | H2SO4和NaOH反应的中和热是HCl和NaOH反应的中和热的两倍 | |
| B. | CO的标准燃烧热是△H=-283.0KJ/mol,则反应2CO2(g)═2CO(g)+O2(g)的△H=+566.0KJ/mol | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 甲烷完全燃烧生成液态水和二氧化碳气体所放出的热量是甲烷的标准燃烧热 |
16.下列对物质的结构组成表示正确的是( )
| A. | HClO的结构式H-Cl-O | B. | 硫离子的结构示意图 | ||
| C. | 二氧化碳的电子式 | D. | 过氧化钠的电子式 |
 钢化玻璃是一类性能良好的玻璃,它可以克服玻璃质脆易碎的缺点.离子交换法是玻璃进行钢化的一种重要方法.将普通的钠钙玻璃在碳酸钾的强化盐(475℃)中浸泡3.5小时后即可制得.下图是离子交换法的示意图.
钢化玻璃是一类性能良好的玻璃,它可以克服玻璃质脆易碎的缺点.离子交换法是玻璃进行钢化的一种重要方法.将普通的钠钙玻璃在碳酸钾的强化盐(475℃)中浸泡3.5小时后即可制得.下图是离子交换法的示意图.