题目内容
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如图1:
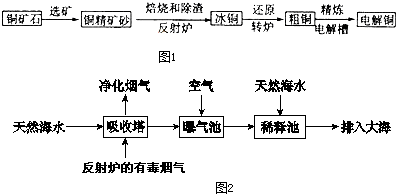
(1)在反射炉中,把铜精矿砂和石英砂混合加热到1000℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转化为低价氧化物.该过程中两个主要反应的化学方程式是 、 ;
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%.转炉中,将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼.冰铜中的Cu2S被氧化成Cu2O,生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程发生反应的化学方程式是 、 ;
(3)海水呈弱碱性,主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、HCO3-等离子.反射炉中所产生的有毒烟气可利用海水处理,其工艺流程如图2所示:
①向曝气池中通入空气的目的是 .
②通入空气后曝气池中海水与天然海水相比,浓度可能改变的离子是 .(不考虑海水的体积因素)
a.Cl- b.SO42- c.Br- d.HCO3-
③若将反射炉中所产生的有毒烟气中的主要成分与NaOH溶液中的溶质按1:1反应,所得溶液呈酸性或碱性的原因是 .

(1)在反射炉中,把铜精矿砂和石英砂混合加热到1000℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转化为低价氧化物.该过程中两个主要反应的化学方程式是
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%.转炉中,将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼.冰铜中的Cu2S被氧化成Cu2O,生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程发生反应的化学方程式是
(3)海水呈弱碱性,主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、HCO3-等离子.反射炉中所产生的有毒烟气可利用海水处理,其工艺流程如图2所示:
①向曝气池中通入空气的目的是
②通入空气后曝气池中海水与天然海水相比,浓度可能改变的离子是
a.Cl- b.SO42- c.Br- d.HCO3-
③若将反射炉中所产生的有毒烟气中的主要成分与NaOH溶液中的溶质按1:1反应,所得溶液呈酸性或碱性的原因是
考点:物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计
专题:实验设计题
分析:(1)黄铜矿与空气反应生成Cu和Fe的低价硫化物:产物为Cu2S、FeS;部分Fe的硫化物转变为Fe的低价氧化物:产物为FeO;反射炉内生成炉渣的主要成分是FeSiO3;
(2)Cu2S被氧化为Cu2O:2Cu2S+3O2
2Cu2O+2SO2;Cu2O与Cu2S反应:2Cu2O+Cu2S
6Cu+2SO2↑;
(3)①含SO2的烟气可利用海水脱硫,向曝气池中通入空气的目的是把H2SO3、HSO3-等氧化为SO42-;
②由上一问可知硫酸根浓度肯定增大,天然海水呈弱碱性,通入空气后曝气池中的海水会生成酸性物质会消耗HCO3-,HCO3-会减少;
③过量的二氧化硫与氢氧化钠溶液反应生成亚硫酸氢钠,据此分析溶液酸碱性.
(2)Cu2S被氧化为Cu2O:2Cu2S+3O2
| ||
| ||
(3)①含SO2的烟气可利用海水脱硫,向曝气池中通入空气的目的是把H2SO3、HSO3-等氧化为SO42-;
②由上一问可知硫酸根浓度肯定增大,天然海水呈弱碱性,通入空气后曝气池中的海水会生成酸性物质会消耗HCO3-,HCO3-会减少;
③过量的二氧化硫与氢氧化钠溶液反应生成亚硫酸氢钠,据此分析溶液酸碱性.
解答:
解:(1)黄铜矿与空气反应生成Cu2S、FeS,根据化合价升降相等配平,反应方程式为:2CuFeS2+O2
Cu2S+2FeS+SO2;FeS和氧气反应生成FeO,根据化合价升降相等,配平方程式为:FeS+3O2
2FeO+2SO2,生成炉渣的主要成分为:FeSiO3,
故答案是:2CuFeS2+O2
Cu2S+2FeS+SO2;FeS+3O2
2FeO+2SO2 ;
(2)Cu2S被氧化为Cu2O的反应方程式为:2Cu2S+3O2
2Cu2O+2SO2;Cu2O与Cu2S发生反应的方程式为:2Cu2O+Cu2S
6Cu+2SO2↑,
故答案是:2Cu2S+3O2
2Cu2O+2SO2;2Cu2O+Cu2S
6Cu+2SO2↑;
(3)①含SO2的烟气可利用海水脱硫,向曝气池中通入空气的目的是把H2SO3、HSO3-等氧化为SO42-,故答案为:将H2SO3、HSO3-等氧化为SO42-;
②天然海水呈弱碱性,通入空气后曝气池中的海水会生成酸性物质,会导致HCO3-减少,故答案为:d;
③氢氧化钠溶液能够与二氧化硫气体1:1反应生成亚硫酸氢钠,反应的离子方程式为:SO2+OH-═HSO3-,亚硫酸氢根离子电离大于水解,溶液呈酸性,
故答案为:亚硫酸氢根离子电离大于水解,溶液呈酸性.
| ||
| ||
故答案是:2CuFeS2+O2
| ||
| ||
(2)Cu2S被氧化为Cu2O的反应方程式为:2Cu2S+3O2
| ||
| ||
故答案是:2Cu2S+3O2
| ||
| ||
(3)①含SO2的烟气可利用海水脱硫,向曝气池中通入空气的目的是把H2SO3、HSO3-等氧化为SO42-,故答案为:将H2SO3、HSO3-等氧化为SO42-;
②天然海水呈弱碱性,通入空气后曝气池中的海水会生成酸性物质,会导致HCO3-减少,故答案为:d;
③氢氧化钠溶液能够与二氧化硫气体1:1反应生成亚硫酸氢钠,反应的离子方程式为:SO2+OH-═HSO3-,亚硫酸氢根离子电离大于水解,溶液呈酸性,
故答案为:亚硫酸氢根离子电离大于水解,溶液呈酸性.
点评:本题考查铜及其化合物的性质,特别是阅读信息、处理信息的能力,难度稍大.

练习册系列答案
相关题目