题目内容
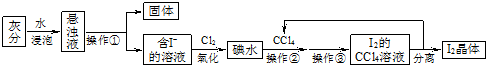
海藻中富含碘元素.某小组同学在实验室里用灼烧海藻的灰分提取碘,流程如图.
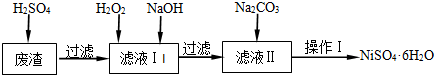
(1)写出操作名称:操作① ,操作③ .
(2)用NaOH浓溶液反萃取后再加稀酸,可以分离I2和CCl4.有关化学方程式为:
碱性条件,3I2+6NaOH=5NaI+NaIO3+3H2O,
酸性条件,5NaI+NaIO3+3H2SO4=3Na2SO4+3I2+H2O.
以下是反萃取过程的操作,请填写相关空格:
①向装有I2的CCl4溶液的 (填仪器名称)中加入少量1mol?L-1 NaOH溶液;
②振荡至溶液的 色消失,静置、分层,则 (填“上”、“下”)层为CCl4;
③将含碘的碱溶液从仪器的 (填“上”、“下”)口倒入烧杯中;
④边搅拌边加入几滴1mol?L-1H2SO4溶液,溶液立即转为棕黄色,并析出碘晶体;
(3)本实验中可以循环利用的物质是 .

(1)写出操作名称:操作①
(2)用NaOH浓溶液反萃取后再加稀酸,可以分离I2和CCl4.有关化学方程式为:
碱性条件,3I2+6NaOH=5NaI+NaIO3+3H2O,
酸性条件,5NaI+NaIO3+3H2SO4=3Na2SO4+3I2+H2O.
以下是反萃取过程的操作,请填写相关空格:
①向装有I2的CCl4溶液的
②振荡至溶液的
③将含碘的碱溶液从仪器的
④边搅拌边加入几滴1mol?L-1H2SO4溶液,溶液立即转为棕黄色,并析出碘晶体;
(3)本实验中可以循环利用的物质是
考点:物质分离和提纯的方法和基本操作综合应用,海水资源及其综合利用
专题:实验设计题
分析:流程分析可知,灰分加水溶解浸泡后过滤的含I-的溶液,加入氯气氧化得到碘水,加入四氯化碳萃取后分液、蒸馏得到碘晶体,四氯化碳循环使用;
(1)分析流程可知操作①是分离固体和液体,操作③是分离互不相溶的液体用分液方法分离;
(2)①用NaOH浓溶液反萃取后再加稀酸,可以分离I2和CCl4,向装有I2的CCl4溶液的分液漏斗中加入氢氧化钠溶液正当进行反萃取;
②振荡至溶液紫红色消失,碘单质和氢氧化钠反应,静置分层,四氯化碳密度 大在下层;
③含碘的碱溶液从分液漏斗上口倒出;
(3)参与实验过程,最后重新生成的物质可以循环使用.
(1)分析流程可知操作①是分离固体和液体,操作③是分离互不相溶的液体用分液方法分离;
(2)①用NaOH浓溶液反萃取后再加稀酸,可以分离I2和CCl4,向装有I2的CCl4溶液的分液漏斗中加入氢氧化钠溶液正当进行反萃取;
②振荡至溶液紫红色消失,碘单质和氢氧化钠反应,静置分层,四氯化碳密度 大在下层;
③含碘的碱溶液从分液漏斗上口倒出;
(3)参与实验过程,最后重新生成的物质可以循环使用.
解答:
解:流程分析可知,灰分加水溶解浸泡后过滤的含I-的溶液,加入氯气氧化得到碘水,加入四氯化碳萃取后分液、蒸馏得到碘晶体,四氯化碳循环使用;
(1)分析流程可知操作①是分离固体和液体,实验操作为过滤,操作③是分离互不相溶的液体用分液方法分离,实验操作为分液,
故答案为:过滤;分液;
(2)①用NaOH浓溶液反萃取后再加稀酸,可以分离I2和CCl4,向装有I2的CCl4溶液的分液漏斗中加入氢氧化钠溶液正当进行反萃取;
故答案为:分液漏斗;
②振荡碘单质和氢氧化钠反应,至溶液紫红色消失,静置分层,四氯化碳密度大在分液漏斗的下层,从下层放出,故答案为:紫红;下;
③含碘的碱溶液从分液漏斗上口倒出,故答案为:上;
(3)参与实验过程,最后重新生成的物质可以循环使用,流程分析可知四氯化碳可以循环使用,故答案为:CCl4 .
(1)分析流程可知操作①是分离固体和液体,实验操作为过滤,操作③是分离互不相溶的液体用分液方法分离,实验操作为分液,
故答案为:过滤;分液;
(2)①用NaOH浓溶液反萃取后再加稀酸,可以分离I2和CCl4,向装有I2的CCl4溶液的分液漏斗中加入氢氧化钠溶液正当进行反萃取;
故答案为:分液漏斗;
②振荡碘单质和氢氧化钠反应,至溶液紫红色消失,静置分层,四氯化碳密度大在分液漏斗的下层,从下层放出,故答案为:紫红;下;
③含碘的碱溶液从分液漏斗上口倒出,故答案为:上;
(3)参与实验过程,最后重新生成的物质可以循环使用,流程分析可知四氯化碳可以循环使用,故答案为:CCl4 .
点评:本题考查了流程分析,混合物分离方法和提纯的实验过程分析,掌握基础是关键,题目难度中等.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
下列实验装置图所示的实验操作,不能达到相应的实验目的是( )
A、 检查装置气密性 |
B、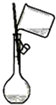 向容量瓶中转移液体 |
C、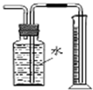 测量Cu与浓硝酸产生气体体积 |
D、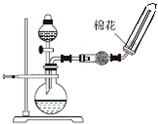 实验室制取并收集NH3 |
以下分离混合物的操作中,不正确的是( )
A、蒸发时,蒸发皿内所盛液体不超过蒸发皿容积的
| ||
| B、蒸发结晶时,不能直接蒸干液体,最后少量液体用余热蒸干 | ||
| C、用四氯化碳萃取碘水中的碘,分液时四氯化碳碘溶液从上口倒出 | ||
| D、蒸馏时,要在烧瓶中加入几粒碎瓷片 |