题目内容
3.化学与人类社会可持续发展密切相关,能源、环境、材料以及日常生活等都离不开化学.(1)硅是无机非金属材料的主角.请你举出两种含硅的材料名称玻璃、水泥、陶瓷、光导纤维等;铝制品表面因有一层氧化铝薄膜而经久耐用,但该氧化膜易被酸、碱破坏.若将氧化铝与氢氧化钠溶液作用,反应的离子方程式为Al2O3+2OH-═2AlO2-+H2O.
(2)氯气用于漂白时,实际上起漂白作用的物质不是Cl2而是它和水反应生成的HClO(写化学式).缺铁性贫血患者补充的铁,通常以硫酸亚铁的形式,而硫酸铁则没有这种药效.当用硫酸亚铁制成药片时外表要包有一层特殊的糖衣,这层糖衣的作用是防止Fe2+被氧化.
(3)从降低成本和减少环境污染的角度考虑,制取硫酸铜最好的方法是C(填字母).
A.铜和浓硫酸反应
B.铜和稀硫酸反应
C.氧化铜和稀硫酸反应
D.铜与Fe2(SO4)3溶液反应.
分析 (1)常见含硅材料有玻璃、水泥、陶瓷、光导纤维等;氧化铝与强碱反应生成偏铝酸钠和水;
(2)次氯酸具有漂白性,而氯气不具有漂白作用,亚铁离子具有还原性,易被氧化;
(3)铜浓硫酸反应均会产生污染性的气体,铜与Fe2(SO4)3溶液反应反应生成混合物.
解答 解:(1)常见含硅材料有玻璃、水泥、陶瓷、光导纤维等,其中玻璃、水泥、陶瓷为传统硅酸盐工业产品;氧化铝与强碱反应生成偏铝酸钠和水,反应的离子方程式为:Al2O3+2OH-═2AlO2-+H2O;
故答案为:玻璃;水泥、陶瓷、光导纤维等;Al2O3+2OH-═2AlO2-+H2O;
(2)次氯酸因具有氧化性而有漂白性,亚铁离子具有还原性,易被氧化,
故答案为:HClO;防止Fe2+被氧化;
(3)A、铜和浓硝酸反应生成二氧化氮,会产生污染,故A错误;
B、铜和稀硫酸不反应,不能制得硫酸铜,故A错误;
C、氧化铜和硫酸反应生成硫酸铜和水,产物无污染,故C正确;
D、铜与Fe2(SO4)3溶液反应生成硫酸铜和硫酸亚铁,二者不容易分离,故D错误.
故答案为:C.
点评 本题考查含硅矿物及材料的应用、铝、Cu、Fe等元素的化合物的性质,题目难度不大,注意把握常见物质的性质以及有关方程式的书写.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
14.已知A、B、C、D、E是短周期中原子序数依次增大的5种元素,B、C同周期,D、E也同周期,D原子最外层电子数与最内层电子数相等,A、B、C、D的原子序数之和是E的两倍,D与C形成的化合物是一种耐高温材料,A、B形成的气态化合物的水溶液呈碱性.下列说法正确的是( )
| A. | A、B、C三种元素形成的化合物中肯定只含共价键 | |
| B. | A、C形成的化合物中只有A-C键 | |
| C. | 工业上生产单质D可用海水作原料获得 | |
| D. | 化合物DC与化合物EC2中化学键类型相同 |
11.对比甲烷和乙烯的燃烧反应,下列叙述中正确的是( )
| A. | 二者燃烧时现象完全相同 | |
| B. | 点燃前都不需要验纯 | |
| C. | 甲烷燃烧火焰呈淡蓝色,乙烯燃烧火焰较明亮 | |
| D. | 二者燃烧时都有黑烟生成 |
18.除去NaHCO3溶液中混有的少量Na2CO3,应采取最理想的方法是( )
| A. | 加入稀盐酸 | B. | 加入NaOH溶液 | C. | 加入澄清石灰水 | D. | 通入CO2 |
8.下列反应的离子方程式正确的是( )
| A. | 往Na[Al(OH)4]溶液中通入过量CO22[Al(OH)4]-+CO2=2Al(OH)3↓+CO32-+H2O | |
| B. | Na2SiO3溶液与稀醋酸混合SiO32-+2H+=H2SiO3↓ | |
| C. | 钠与CuSO4溶液反应2Na+Cu2+=Cu+2Na+ | |
| D. | 往Na2SO3溶液中滴加双氧水 H2O2+SO32-=SO42-+H2O |
15.硅是无机非金属材料的主角,硅芯片的使用,促进了信息技术的革命.
(1)陶瓷、水泥和玻璃都属于传统硅酸盐材料.其中,生产普通玻璃的主要原料除了SiO2、Na2CO3外还CaCO3.玻璃制作过程中发生了Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2的反应,碳酸酸性强于硅酸,但为什么该反应可在高温下发生?高温下Na2SiO3的稳定性比Na2CO3强.
(2)工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如图:
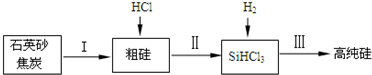
①请写出反应Ⅱ、Ⅲ的化学方程式:ⅡSi+3HCl$\frac{\underline{\;\;△\;\;}}{\;}$SiHCl3+H2、ⅢSiHCl3+H2$\frac{\underline{\;高温\;}}{\;}$Si+3HCl;
②在流化床反应的产物中,SiHCl3大约占85%,所含有的其它物质的沸点数据如下表:
提纯SiHCl3的主要工艺操作依次是沉降、冷凝和分馏(相当于多次蒸馏).沉降是为了除去Si;在空气中冷凝所得液体主要含有SiCl4、SiHCl3;若在实验室进行分馏提纯液体,应该采取以下加热方法中的D;
A.电炉加热 B.酒精灯加热 C.砂浴加热 D.水浴加热
③SiHCl3极易水解,其完全水解时的反应方程式为SiHCl3+4H2O=H4SiO4+H2↑+3HCl.
(1)陶瓷、水泥和玻璃都属于传统硅酸盐材料.其中,生产普通玻璃的主要原料除了SiO2、Na2CO3外还CaCO3.玻璃制作过程中发生了Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2的反应,碳酸酸性强于硅酸,但为什么该反应可在高温下发生?高温下Na2SiO3的稳定性比Na2CO3强.
(2)工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如图:

①请写出反应Ⅱ、Ⅲ的化学方程式:ⅡSi+3HCl$\frac{\underline{\;\;△\;\;}}{\;}$SiHCl3+H2、ⅢSiHCl3+H2$\frac{\underline{\;高温\;}}{\;}$Si+3HCl;
②在流化床反应的产物中,SiHCl3大约占85%,所含有的其它物质的沸点数据如下表:
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
A.电炉加热 B.酒精灯加热 C.砂浴加热 D.水浴加热
③SiHCl3极易水解,其完全水解时的反应方程式为SiHCl3+4H2O=H4SiO4+H2↑+3HCl.
12.生活中处处有化学.请根据你所学过的化学知识,判断下列说法中错误的是( )
| A. | 使用液化石油气可以完全杜绝厨房污染 | |
| B. | 为防止流感传染,可将教室门窗关闭后,用食醋熏蒸,进行消毒 | |
| C. | 氯化钠是家庭常用的防腐剂,可用来腌制食品 | |
| D. | 医疗上常用体积分数为70%~75%的酒精作消毒剂 |
13.以下分散系,不会出现丁达尔现象的是( )
| A. | 鸡蛋清溶液 | B. | 淀粉溶液 | C. | 食盐水 | D. | 雾 |

 ;其反应类型是消去反应.
;其反应类型是消去反应.