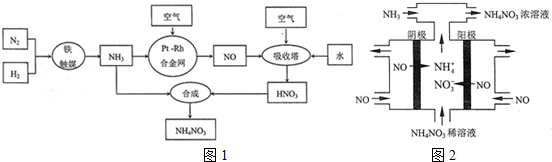
题目内容
12.生活中处处有化学.请根据你所学过的化学知识,判断下列说法中错误的是( )| A. | 使用液化石油气可以完全杜绝厨房污染 | |
| B. | 为防止流感传染,可将教室门窗关闭后,用食醋熏蒸,进行消毒 | |
| C. | 氯化钠是家庭常用的防腐剂,可用来腌制食品 | |
| D. | 医疗上常用体积分数为70%~75%的酒精作消毒剂 |
分析 A.使用液化气可以减少污染但是不能杜绝污染;
B.食醋的有效成分为醋酸,具有杀菌作用;
C.氯化钠具有咸味,常用来做调味品和防腐剂;
D.75%的酒精对细菌蛋白质的渗透效果最好.
解答 解:A.使用液化气可以减少污染,但是不能杜绝污染,故A错误;
B.食醋能杀菌,为防止流感传染,可将教室门窗关闭后,用食醋熏蒸,进行消毒,故B正确;
C.氯化钠常用来做调味品和防腐剂,故C正确;
D.实践证明,75%的酒精对细菌的渗透能力最强,杀菌效果最好,故D正确.
故选A.
点评 本题主要考查物质的性质、组成以及用途,题目难度不大,学习中注意相关基础知识的积累.

练习册系列答案
相关题目
2.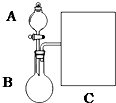 氨水是一种的常用的化学试剂.
氨水是一种的常用的化学试剂.
(1)以浓氨水和生石灰为原料,用如下装置为发生装置,可制取少量氨气.
已知:NH3•H2O+CaO=Ca(OH)2+NH3↑.
①生石灰应该装在B(填A或B).
②试从电离平衡角度分析该实验中氨气逸出的原因:CaO与水反应生成Ca(OH)2,溶液中OH-浓度增大,使NH3+H2O?NH4++OH-平衡逆向移动,有利于NH3逸出.
③现要用试管和必要实验用品收集一试管氨气,请在C处补充相应收集装置.
(2)化学兴趣小组用氨水与硝酸银溶液配制好银氨溶液后,进行乙醛的银镜反应实验,但部分同学实验时间长,且效果不明显.影响乙醛银镜反应速率的因素有哪些呢?请你完成如下猜想:
①猜想:因素一:银氨溶液的pH大小;
因素二:反应(水浴)的温度.
②你设计实验验证上述影响因素一,完成下表中内容.
提供试剂:乙醛、2%稀氨水、0.25mol/L NaOH溶液、盐酸、2% AgNO3溶液
实验用品:烧杯(装有热水)、试管
(3)吸取20.00ml 上述氨水于锥形瓶,滴加3滴甲基橙指示剂,用0.0050mol/L标准硫酸滴定,滴定至出现红色为终点,重复3次实验,平均消耗标准硫酸20.04ml,计算上述氨水的物质的量浓度0.01002 mol/L.
 氨水是一种的常用的化学试剂.
氨水是一种的常用的化学试剂.(1)以浓氨水和生石灰为原料,用如下装置为发生装置,可制取少量氨气.
已知:NH3•H2O+CaO=Ca(OH)2+NH3↑.
①生石灰应该装在B(填A或B).
②试从电离平衡角度分析该实验中氨气逸出的原因:CaO与水反应生成Ca(OH)2,溶液中OH-浓度增大,使NH3+H2O?NH4++OH-平衡逆向移动,有利于NH3逸出.
③现要用试管和必要实验用品收集一试管氨气,请在C处补充相应收集装置.
(2)化学兴趣小组用氨水与硝酸银溶液配制好银氨溶液后,进行乙醛的银镜反应实验,但部分同学实验时间长,且效果不明显.影响乙醛银镜反应速率的因素有哪些呢?请你完成如下猜想:
①猜想:因素一:银氨溶液的pH大小;
因素二:反应(水浴)的温度.
②你设计实验验证上述影响因素一,完成下表中内容.
提供试剂:乙醛、2%稀氨水、0.25mol/L NaOH溶液、盐酸、2% AgNO3溶液
实验用品:烧杯(装有热水)、试管
| 实验步骤 | 实验操作 | 预期现象及结论(步骤1只填现象) |
| 1 | 在A、B两支洁净的试管中各入1mL 2%的AgNO3溶液,然后边振荡试管边逐滴滴入2%稀氨水,至最初产生的沉淀恰好完全溶解,此时制得pH均约为8的银氨溶液. | 先出现白色沉淀后沉淀溶解 |
| 2 | 往A、B试管加入3滴乙醛,然后在A试管中加多1滴NaOH溶液;振荡后将两支试管放在热水浴中温热 | 若A试管比B试管出现的银镜时间短、光亮,则溶液pH大,反应速率快;若A试管比B试管出现的银镜时间长,则溶液pH大,反应速率慢 |
20.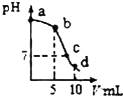 25℃时,向10mL0.2mol•L-1NaCN溶液中加入0.2mol•L-1盐酸,溶液pH随加入盐酸的体积变化情况如如图所示.,则下列说法不正确的是( )已知:Ka(HCN)=6.4×10-10.
25℃时,向10mL0.2mol•L-1NaCN溶液中加入0.2mol•L-1盐酸,溶液pH随加入盐酸的体积变化情况如如图所示.,则下列说法不正确的是( )已知:Ka(HCN)=6.4×10-10.
 25℃时,向10mL0.2mol•L-1NaCN溶液中加入0.2mol•L-1盐酸,溶液pH随加入盐酸的体积变化情况如如图所示.,则下列说法不正确的是( )已知:Ka(HCN)=6.4×10-10.
25℃时,向10mL0.2mol•L-1NaCN溶液中加入0.2mol•L-1盐酸,溶液pH随加入盐酸的体积变化情况如如图所示.,则下列说法不正确的是( )已知:Ka(HCN)=6.4×10-10.| A. | a点时,CN-离子浓度大于其他点 | B. | b点时,c(HCN)>c(CN-) | ||
| C. | c点时,c(Na+)=c(Cl-)+c(CN-) | D. | d点时,溶液的c(H+)≈8×10-5mol•L-1 |
17.下列变化不属于氧化还原反应的是( )
| A. | Na2O+H2O═2NaOH | B. | Zn+H2SO4(稀)═ZnSO4+H2↑ | ||
| C. | 2AgNO3═2Ag+2NO2↑+O2↑ | D. | 3NO2+H2O═2HNO3+NO |
1.正确掌握好化学用语是学好化学的基础,下列有关表述正确的是( )
| A. | 质量数为16的氧原子:${\;}_{16}^{8}$O | |
| B. | 苛性钠化学式:Na2CO3 | |
| C. | 镁离子结构示意图: | |
| D. | 次氯酸钠在水中电离:NaClO═Na++Cl-+O2- |
2.下列离子方程式改写成化学方程式正确的是( )
| A. | Cu2++2OH-═Cu(OH)2↓ CuCO3+2NaOH═Cu(OH)2↓+Na2CO3 | |
| B. | CO32-+2H+═CO2↑+H2O BaCO3+2HCl═BaCl2+CO2↑+H2O | |
| C. | Ca2++CO32-═CaCO3↓ Ca(NO3)2+Na2CO3═CaCO3↓+2NaNO3 | |
| D. | H++OH-═H2O Ba(OH)2+H2SO4═BaSO4+2H2O |