题目内容
17.设NA为阿伏加德罗常数的值,下列说法不正确的是( )| A. | 标准状况下,22.4L乙醇含有2NA个碳子 | |
| B. | 常温常压下,17g羟基含有9NA个电子 | |
| C. | 28g乙烯和丙烯(C3H6)的混合气体中含有的碳原子数为2NA | |
| D. | 1molNa被完全氧化生成Na2O2,失去NA个电子 |
分析 A.标准状况下,乙醇的状态不是气态;
B.羟基中含有9个电子,17g羟基的物质的量为1mol,含有9mol电子;
C.乙烯和丙烯的最简式CH2,根据最简式计算出混合物中含有的碳原子数;
D.钠为+1价金属,1mol钠完全反应失去1mol电子.
解答 解:A.标准状况下,乙醇不是气体,不能使用标准状况下的气体摩尔体积计算,故A错误;
B.17g羟基的物质的量为:$\frac{17g}{17g/mol}$=1mol,1mol羟基中含有9mol电子,含有9NA个电子,故B正确;
C.28g乙烯和丙烯的混合物中含有28g最简式CH2,含有CH2的物质的量为:$\frac{28g}{14g/mol}$=2mol,则该混合物中含有碳原子的物质的量为2mol,含有的碳原子数为2NA,故C正确;
D.1mol钠完全反应生成过氧化钠,失去了1mol电子,失去NA个电子,故D正确;
故选A.
点评 本题考查物质的量的计算,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系,试题培养了学生的灵活应用能力.

 阅读快车系列答案
阅读快车系列答案回答下列问题:
(1)莫尔盐在空气中比硫酸亚铁稳定,但长期露置于空气中也会变质,检验莫尔盐是否变质的试剂是KSCN溶液.
(2)准确称取mg纯净的莫尔盐,在锥形瓶中加人20mL水充分溶解,用某酸性K2Cr2O7溶液滴定至终点.重复进行3次,测得有关数据如下:
| 实验序号 | 起始读数/mL | 终点读数/mL |
| I | 2.50 | 22.58 |
| Ⅱ | 1.00 | 23.12 |
| Ⅲ | 0.00 | 19.92 |
②写出滴定过程中反应的离子方程式:6Fe2++14H++Cr2O72-=2Cr3++6Fe3++7H2O;
③所测K2Cr2O7溶液的物质的量浓度为$\frac{m}{47.04}$mol/L(用含M的代数式表示).
(3)某课题组通过实验检验莫尔盐晶体加热时的分解产物.
①甲同学提出猜想:分解产物可能是N2、Fe2O3,SO3、H2O四种物质.你是否同意并说明理由:不同意,N、Fe的化合价均升高,没有化合价降低的元素.
②乙同学设计了如图1装置,其中A装置中的固体变为红棕色,则固体产物中含有Fe2O3;C装置中红色褪去,说明气体产物中含有SO2;
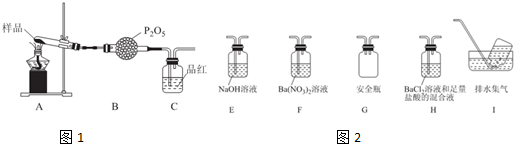
C装置后应连接尾气吸收装置D,D中盛有的试剂可以是NaOH溶液(写一种即可).
③丙同学想利用上述装置证明分解产物中含有氨气.只需更换B,C中的试剂即可,则更换后的试剂为B碱石灰、C酚酞溶液.
④丁同学认为莫尔盐分解可能会生成N2,SO3,拟从下列装置如图2中选择必要的装置加以证明.则正确的连接顺序从左到右依次是A、G、H、I.
| A. | 乙烯的结构简式为CH2CH2 | B. | 羟基的电子式: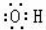 | ||
| C. | Ca2+的结构示意图为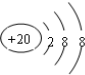 | D. | 乙醇的分子式:CH3CH2OH |
| A. | 将废水加入紫色石蕊试剂中检验酸碱性 | |
| B. | 用玻璃棒蘸取废水样品,蘸在润湿的pH试纸上测定其pH | |
| C. | 测得该废水样品的pH=10,则废水样品中c(OH-)=10-10 mol/L | |
| D. | 该工业废水中c(H+)<c(OH-) |
| 成分的质量/g | 摩尔质量/(g•mol-1?) |
蔗糖 | 25.00 | 342 |
硫酸钾 | 0.87 | 174 |
阿司匹林 | 0.17 | 180 |
高锰酸钾 | 0.316 | 158 |
硝酸银 | 0.02 | 170 |
(1)下列“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为__________mol•L-1(要求:用原始数据写出表达式即可,不需要化简与计算)。
(2)配制上述“鲜花保鲜剂”所需的仪器有烧杯、玻璃棒、药匙、托盘天平(带砝码)、
____________________(填所缺仪器的名称)。
(3)在溶液配制过程中,下列操作对配制结果没有影响的是_________(填字母).
A.定容时,俯视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(4)若要配制0.5mol·L-1500ml的硫酸溶液,则:
①所需质量分数为98%、密度为1.84g·cm-3的浓硫酸的体积为___________(计算结果保留一位小数)mL;
②如果实验室有15mL、20mL、50mL量筒,应选用___________mL量筒最好;
③配制过程中需先在烧杯中将浓硫酸稀释,稀释时操作方法是_____________________.
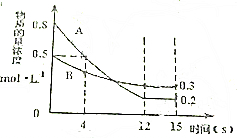 已知:反应aA(g)+bB(g)?cC(g)某温度下,在2L的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示.
已知:反应aA(g)+bB(g)?cC(g)某温度下,在2L的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示.