题目内容
9.有碳酸钠和碳酸氢钠的混合物146g,在500℃下加热至恒重时,剩余物的质量是133.6g,计算混合物中纯碱的质量分数和反应(标准状况下)放出二氧化碳的体积(升).分析 加热发生反应为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,计算出固体质量差,利用差量法计算碳酸氢钠的质量、二氧化碳的物质的量,从而可计算出混合物中纯碱的质量分数和反应(标准状况下)放出二氧化碳的体积.
解答 解:碳酸钠和碳酸氢钠的混合物146g,在500℃下加热至恒重时,剩余物的质量是133.6g,固体减少的质量为:146g-133.6g=12.4g,
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑△m
84×2g 1mol 62g
m(NaHCO3) n(CO2) 12.4g
则:m(NaHCO3)=$\frac{84×2g×12.4g}{62g}$=33.6g,
n(CO2)=$\frac{1mol×12.4g}{62g}$=0.2mol,
混合物中碳酸钠的质量分数为:$\frac{146g-33.6g}{146g}$×100%=77.0%;
标准状况下0.2mol二氧化碳的体积为:22.4L/mol×0.2mol=4.48L,
答:混合物中纯碱的质量分数为77.0%,反应(标准状况下)放出二氧化碳的体积为4.48L.
点评 本题考查了化学方程式、物质的量的计算,题目难度中等,明确发生反应的原理为解答关键,注意掌握差量法在化学计算中等应用,试题培养了学生的化学计算能力.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
17.设NA为阿伏加德罗常数的值,下列说法不正确的是( )
| A. | 标准状况下,22.4L乙醇含有2NA个碳子 | |
| B. | 常温常压下,17g羟基含有9NA个电子 | |
| C. | 28g乙烯和丙烯(C3H6)的混合气体中含有的碳原子数为2NA | |
| D. | 1molNa被完全氧化生成Na2O2,失去NA个电子 |
14.在盛有硝酸银溶液的烧杯中放人用导线连接的铜片和银片,下列叙述正确的是( )
| A. | 正极质量不变 | B. | 电流通过导线由铜片流向银片 | ||
| C. | 烧杯中Ag+浓度逐渐减小 | D. | 电池工作时,铜片失电子,被还原 |
1.秦皮素具有抗痢疾杆菌功效,其结构如图所示,下列有关说法正确的是( )


| A. | 秦皮素分子中有三种类型的官能团 | |
| B. | 1mol秦皮素与过量浓溴水反应时,消耗2molBr2 | |
| C. | 1mol秦皮素最多与3molNaOH发生反应 | |
| D. | 1mol秦皮素最多与5molH2加成 |
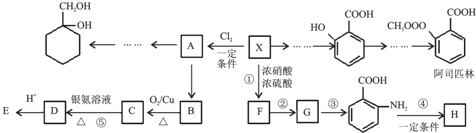
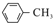 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$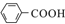
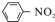 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$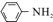 (苯胺,易被氧化)
(苯胺,易被氧化) ,分子中最多有13个原子共面.
,分子中最多有13个原子共面. .
. .
.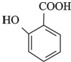 有多种同分异构体,试写出所有苯环上含有1个醛基和2个羟基,且核磁共振氢谱显示为4组峰的芳香族化合物的结构简式
有多种同分异构体,试写出所有苯环上含有1个醛基和2个羟基,且核磁共振氢谱显示为4组峰的芳香族化合物的结构简式 .
.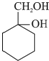 最合理的方案.在合成路线流程图的方框中填出相应的物质,并在括号注明反应条件.
最合理的方案.在合成路线流程图的方框中填出相应的物质,并在括号注明反应条件.