题目内容
8.(NH4)2Fe(SO4)2•6H2O(莫尔盐,浅绿色,式量392)在定量分析中常用作标定高锰酸钾、重铬酸钾等溶液的标准物质,还用作化学试剂、医药以及用于冶金、电镀等.回答下列问题:
(1)莫尔盐在空气中比硫酸亚铁稳定,但长期露置于空气中也会变质,检验莫尔盐是否变质的试剂是KSCN溶液.
(2)准确称取mg纯净的莫尔盐,在锥形瓶中加人20mL水充分溶解,用某酸性K2Cr2O7溶液滴定至终点.重复进行3次,测得有关数据如下:
| 实验序号 | 起始读数/mL | 终点读数/mL |
| I | 2.50 | 22.58 |
| Ⅱ | 1.00 | 23.12 |
| Ⅲ | 0.00 | 19.92 |
②写出滴定过程中反应的离子方程式:6Fe2++14H++Cr2O72-=2Cr3++6Fe3++7H2O;
③所测K2Cr2O7溶液的物质的量浓度为$\frac{m}{47.04}$mol/L(用含M的代数式表示).
(3)某课题组通过实验检验莫尔盐晶体加热时的分解产物.
①甲同学提出猜想:分解产物可能是N2、Fe2O3,SO3、H2O四种物质.你是否同意并说明理由:不同意,N、Fe的化合价均升高,没有化合价降低的元素.
②乙同学设计了如图1装置,其中A装置中的固体变为红棕色,则固体产物中含有Fe2O3;C装置中红色褪去,说明气体产物中含有SO2;
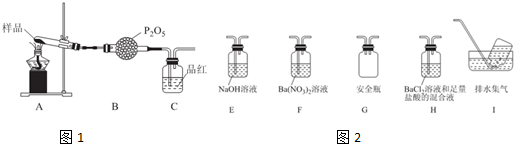
C装置后应连接尾气吸收装置D,D中盛有的试剂可以是NaOH溶液(写一种即可).
③丙同学想利用上述装置证明分解产物中含有氨气.只需更换B,C中的试剂即可,则更换后的试剂为B碱石灰、C酚酞溶液.
④丁同学认为莫尔盐分解可能会生成N2,SO3,拟从下列装置如图2中选择必要的装置加以证明.则正确的连接顺序从左到右依次是A、G、H、I.
分析 (1)莫尔盐在空气中比硫酸亚铁稳定,但长期露置于空气中也会变质是盐中亚铁离子被氧化为铁离子,依据铁离子的检验方法选择试剂检验莫尔盐是否变质;
(2)①K2Cr2O7溶液中溶质为强氧化剂,能氧化橡胶管;
②酸性溶液中亚铁离子被重铬酸钾氧化为铁离子,重铬酸钾被还原为铬离子,结合原子守恒和电荷守恒配平书写离子方程式;
③图表数据中Ⅱ数据误差较大舍去,计算平均消耗溶液体积,结合离子方程式定量关系计算得到溶液浓度;
(3)①摩尔盐中N为-3价,Fe为+2价,S为+6价,根据产物中化合价分析;
②(NH4)2Fe(SO4)2•6H2O受热分解的固体为红色固体,依据盐中元素守恒分析判断,红色固体为氧化铁,品红溶液褪色是二氧化硫的特征性质,二氧化硫是酸性氧化物,二氧化硫有毒污染空气,需要尾气吸收,用氢氧化钠溶液吸收;
③验证固体分解生成的气体中生成氨气,用碱石灰干燥气体除去酸性氧化物气体,氨气溶于水反应生成的是一水合氨溶液,一水合氨电离出氢氧根离子溶液显碱性;
④莫尔盐分解可能会生成N2,SO3,拟从下列装置如图2中选择必要的装置加以证明,利用装置A连接装置G安全瓶防止倒吸,通过装置H中的氯化钡溶液和盐酸混合溶液生成白色沉淀硫酸钡,证明生成三氧化硫.
解答 解:(1)莫尔盐在空气中比硫酸亚铁稳定,但长期露置于空气中也会变质是盐中亚铁离子被氧化为铁离子,检验莫尔盐是否变质的试剂是KSCN溶液,加入KSCN溶液后溶液变红色证明被氧化,若不变红色证明未被氧化,
故答案为:KSCN溶液;
(2)①K2Cr2O7溶液中溶质为强氧化剂,能氧化橡胶管,不能盛放在碱式滴定管中,应盛放在酸洗滴定管中,故答案为:酸;
②准确称取mg纯净的莫尔盐,在锥形瓶中加人20mL水充分溶解,用某酸性K2Cr2O7溶液滴定至终点,酸性溶液中亚铁离子被重铬酸钾氧化为铁离子,重铬酸钾被还原为铬离子,反应的离子方程式为:6Fe2++14H++Cr2O72-=2Cr3++6Fe3++7H2O,
故答案为:6Fe2++14H++Cr2O72-=2Cr3++6Fe3++7H2O;
③图表数据中Ⅱ数据误差较大舍去,计算平均消耗溶液体积V=$\frac{22.58-2.5+19.92}{2}$ml=20ml,设重铬酸钾溶液浓度为c,
6Fe2++14H++Cr2O72-=2Cr3++6Fe3++7H2O
6 1
$\frac{m}{392}$mol 0.020L×c
c=$\frac{m}{47.04}$mol/L,
故答案为:$\frac{m}{47.04}$;
(3)①N2、Fe2O3,SO3、H2O反应时有Fe元素的化合价升高,氮元素化合价升高,无元素化合价降低不符合氧化还原反应规律,
故答案为:不同意,N、Fe的化合价均升高,没有化合价降低的元素;
②(NH4)2Fe(SO4)2•6H2O受热分解的固体为红色固体,依据盐中元素守恒分析判断,红色固体只能为氧化铁,品红溶液褪色是二氧化硫的特征性质,C装置中红色褪去,说明气体产物中含有二氧化硫,二氧化硫是酸性氧化物,二氧化硫有毒污染空气,需要尾气吸收,用氢氧化钠溶液吸收,
故答案为:Fe2O3;SO2;NaOH溶液;
③利用上述装置证明分解产物中含有氨气.只需更换B,C中的试剂即可,则更换后的试剂为B干燥管中用碱石灰吸收水蒸气、生成的二氧化硫或三氧化硫,C装置中是酚酞溶液,气体通入会变红色,证明生成的气体为氨气,
故答案为:碱石灰;酚酞溶液;
④要检验生成SO3(g)、N2,在甲组实验中的装置A产生气体后,经过安全瓶后通过氯化钡溶液检验SO3,用排水集气法收集氮气,所以装置依次连接的合理顺序为A、G、H、I;
故答案为:G、H、I.
点评 本题考查性质实验方案设计,侧重考查学生知识综合应用、实验基本操作能力及实验方案设计能力,综合性较强,难点是排列实验先后顺序,根据实验目的及物质的性质进行排列顺序,注意要排除其它因素干扰,题目难度中等.

| A. | O2和O2互为同位素,化学性质相似 | |
| B. | 水是一种非常稳定的化合物,这是由于氢键所致 | |
| C. | 分子晶体中一定存在分子间作用力,但可能没有共价键 | |
| D. | 将标准状况下22.4 L 氨气溶于1 L水配成溶液,可得1 mol•L-1的氨水 |
| A. | 标准状况下,22.4L乙醇含有2NA个碳子 | |
| B. | 常温常压下,17g羟基含有9NA个电子 | |
| C. | 28g乙烯和丙烯(C3H6)的混合气体中含有的碳原子数为2NA | |
| D. | 1molNa被完全氧化生成Na2O2,失去NA个电子 |
 +NaOH$→_{△}^{CaO}$R-H+Na2CO3
+NaOH$→_{△}^{CaO}$R-H+Na2CO3 ,K的结构简式为
,K的结构简式为 .
. ;
;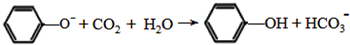 .
. (写结构简式).
(写结构简式).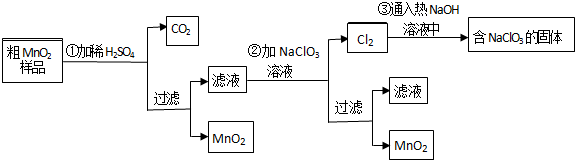
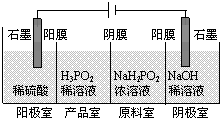 次磷酸(H3PO2)是一种精细化工产品,具有较强还原性,回答下列问题:
次磷酸(H3PO2)是一种精细化工产品,具有较强还原性,回答下列问题: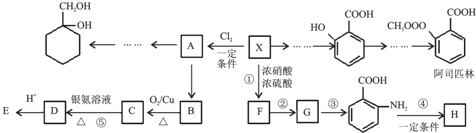
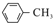 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$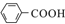
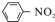 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$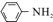 (苯胺,易被氧化)
(苯胺,易被氧化) ,分子中最多有13个原子共面.
,分子中最多有13个原子共面. .
. .
.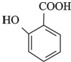 有多种同分异构体,试写出所有苯环上含有1个醛基和2个羟基,且核磁共振氢谱显示为4组峰的芳香族化合物的结构简式
有多种同分异构体,试写出所有苯环上含有1个醛基和2个羟基,且核磁共振氢谱显示为4组峰的芳香族化合物的结构简式 .
. 最合理的方案.在合成路线流程图的方框中填出相应的物质,并在括号注明反应条件.
最合理的方案.在合成路线流程图的方框中填出相应的物质,并在括号注明反应条件.