题目内容
煤气化的一种方法是在气化炉中给煤炭加氢,发生的主要反应为:C(s)+2H2(g)?CH4(g).在VL的容器中投入a mol碳(足量),同时通入2a molH2,控制条件使其发生上述反应,实验测得碳的平衡转化率随压力及温度的变化关系如右图所示.下列说法正确的是( )


| A、上述正反应为吸热反应 | ||
| B、在4MPa、1200K时,图中X点υ(H2)正>υ(H2)逆 | ||
C、在5MPa、800K时,该反应的平衡常数为
| ||
| D、工业上维持6MPa 1000K而不采用10MPa1000K,主要是因为前者碳的转化率高 |
考点:转化率随温度、压强的变化曲线
专题:
分析:A、根据温度对化学平衡的移动的影响知识来回答;
B、根据X点反应的移动方向来确定正反应速率和逆反应速率的关系;
C、根据此点碳的转化率结合三行式进行计算即可;
D、根据压强对反应速率以及平衡的移动的影响并结合生产实际来回答判断.
B、根据X点反应的移动方向来确定正反应速率和逆反应速率的关系;
C、根据此点碳的转化率结合三行式进行计算即可;
D、根据压强对反应速率以及平衡的移动的影响并结合生产实际来回答判断.
解答:
解:A、由图观察,温度越高碳的平衡转化率越大,平衡正向移动,正反应为吸热反应,故A正确;
B、由图观察,X点是未平衡时,反应正向进行,正反应速率大于逆反应速率,故B正确;
C、在5MPa、800K时,此时碳转化率为50%,
C(s)+2H2(g)?CH4(g)
始量量:a 2a
转化量:0.5a a 0.5a
平衡量:0.5a a 0.5a
k=
=
,故C错误;
D、该选择的原因是两者转化率相差不大,但压强增大对设备要求高,能量需求大,故D错误.
故选AB.
B、由图观察,X点是未平衡时,反应正向进行,正反应速率大于逆反应速率,故B正确;
C、在5MPa、800K时,此时碳转化率为50%,
C(s)+2H2(g)?CH4(g)
始量量:a 2a
转化量:0.5a a 0.5a
平衡量:0.5a a 0.5a
k=
| ||
(
|
| 0.5V |
| a |
D、该选择的原因是两者转化率相差不大,但压强增大对设备要求高,能量需求大,故D错误.
故选AB.
点评:本题考查化学平衡有关问题,注意化学平衡状态的判断以及平衡常数的有关计算是解题的关键,难度中等.

练习册系列答案
相关题目
下列说法正确的是( )
| A、原电池是将电能转变为化学能的装置 |
| B、等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 |
| C、电解硫酸钠溶液,在阴极和阳极析出产物的物质的量之比为1:2 |
| D、化石燃料和植物燃料燃烧时放出的能量均来源于太阳能 |
质量百分比浓度分别为80%和20%的硫酸溶液等体积混合,混合溶液的质量百分比浓度为( )
| A、>50% | B、=50% |
| C、<50% | D、无法计算 |
下列叙述正确的是( )
| A、1molNaOH的摩尔质量为40g |
| B、1mol 物质含有的微粒数就是6.02×1023 |
| C、1molN2的体积为22.4L |
| D、0.5molCO2约含有3.01×1023个CO2分子 |
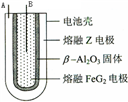 X、Y、Z、M、G五种元素分属三个短周期,原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.请回答下列问题:
X、Y、Z、M、G五种元素分属三个短周期,原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.请回答下列问题: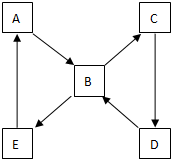 如图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).单质A能与某气态单质化合生成化合物B.
如图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).单质A能与某气态单质化合生成化合物B.