题目内容
下列说法正确的是( )
| A、原电池是将电能转变为化学能的装置 |
| B、等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 |
| C、电解硫酸钠溶液,在阴极和阳极析出产物的物质的量之比为1:2 |
| D、化石燃料和植物燃料燃烧时放出的能量均来源于太阳能 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:A、原电池是化学能转化为电能;
B、等质量的硫蒸气具有的能量比硫固体多;
C、惰性电极电解硫酸钠溶液,实质为电解水;
D、化石燃料和植物燃料具备化学能,化学能来源于太阳能.
B、等质量的硫蒸气具有的能量比硫固体多;
C、惰性电极电解硫酸钠溶液,实质为电解水;
D、化石燃料和植物燃料具备化学能,化学能来源于太阳能.
解答:
解:A、原电池是化学能转化为电能的装置,故A错误;
B、等质量的硫蒸气和硫固体相比较,硫蒸气具有的能量多,因此完全燃烧硫蒸气放出的热量多,故B错误;
C、惰性电极电解硫酸钠溶液,实质为电解水,氢离子在阴极放电生成氢气,氢氧根离子在阳极放电生成氧气,阴极和阳极析出产物的物质的量之比为2:1,故C错误;
D、化石燃料和植物燃料燃烧时放出的能量均来源于太阳能,故D正确;
故选D.
B、等质量的硫蒸气和硫固体相比较,硫蒸气具有的能量多,因此完全燃烧硫蒸气放出的热量多,故B错误;
C、惰性电极电解硫酸钠溶液,实质为电解水,氢离子在阴极放电生成氢气,氢氧根离子在阳极放电生成氧气,阴极和阳极析出产物的物质的量之比为2:1,故C错误;
D、化石燃料和植物燃料燃烧时放出的能量均来源于太阳能,故D正确;
故选D.
点评:本题主要考查的是原电池、化学反应热效应、电解池原理等,题目综合性较强,但是难度不大.

练习册系列答案
 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目
用石墨电极电解足量M(NO3)x的水溶液,当阴极上增重a g时,在阳极上同时产生b L氧气(标准状况),从而可知M的相对原子质量为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
在新制的氯水中存在平衡:Cl2+H2O?HCl+HClO.加入少量下列物质能使c(HClO)增大的是( )
| A、CaCO3 |
| B、CaSO3 |
| C、NaOH |
| D、HCl |
高铁电池是一种新型可充电电池,电解质溶液为KOH,放电时的总反应式为:3Zn+2K2FeO4+8H2O
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述正确的是( )
| 放电 |
| 充电 |
| A、放电时负极反应为:3Zn-6e-+6OH-═3Zn(OH)2 |
| B、放电时OH-向正极移动 |
| C、充电时每转移3 mol电子,阳极有1 mol Fe(OH)3被还原 |
| D、电池充电过程中,KOH的物质的量浓度将增大 |
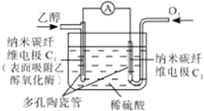 生物燃料电池是以有机物为燃料,直接或简介利用酶作为催化剂的一类特殊的燃料电池,其能量转化效率高,是一种真正意义上的绿色电池.其工作原理如图所示.下列有关说法正确的是( )
生物燃料电池是以有机物为燃料,直接或简介利用酶作为催化剂的一类特殊的燃料电池,其能量转化效率高,是一种真正意义上的绿色电池.其工作原理如图所示.下列有关说法正确的是( )| A、、O2在C2电极上得电子,被氧化 |
| B、电子由C2极经外电路流向C1极 |
| C、每转移6mole-1,理论上生成22.4LCO2 |
| D、C1极的电极反应式为:C2H5OH+3H2O-12e-1=2CO2+12H+ |
已知常温下在溶液里可发生如下两个离子反应:
Ce4++Fe2+═Fe3++Ce3+
Sn2++2Fe3+═2Fe2++Sn4+
由此可以确定Fe3+、Ce4+、Sn4+三种离子的氧化性由强到弱的顺序( )
Ce4++Fe2+═Fe3++Ce3+
Sn2++2Fe3+═2Fe2++Sn4+
由此可以确定Fe3+、Ce4+、Sn4+三种离子的氧化性由强到弱的顺序( )
| A、Sn4+、Fe3+、Ce4+ |
| B、Ce4+、Fe3+、Sn4+ |
| C、Sn4+、Ce4+、Fe3+ |
| D、Fe3+、Sn4+、Ce4+ |
下列说法正确的是( )
| A、1 mol氢的质量为2g |
| B、OH-的摩尔质量为17g |
| C、标准状况下,水的摩尔体积是22.4 L?mol-1 |
| D、1mol Ne 含有的电子数目为6.02×1024 |
煤气化的一种方法是在气化炉中给煤炭加氢,发生的主要反应为:C(s)+2H2(g)?CH4(g).在VL的容器中投入a mol碳(足量),同时通入2a molH2,控制条件使其发生上述反应,实验测得碳的平衡转化率随压力及温度的变化关系如右图所示.下列说法正确的是( )


| A、上述正反应为吸热反应 | ||
| B、在4MPa、1200K时,图中X点υ(H2)正>υ(H2)逆 | ||
C、在5MPa、800K时,该反应的平衡常数为
| ||
| D、工业上维持6MPa 1000K而不采用10MPa1000K,主要是因为前者碳的转化率高 |