题目内容
5.(常温下)下列关于电解质溶液的正确判断的是( )| A. | 在pH=12的溶液中,Al3+、Cl-、HCO3-、Na+可以大量共存 | |
| B. | 在pH=0的溶液中,Na+、NO3-、SO32-、K+可以大量共存 | |
| C. | 由0.1 mol/L-元碱BOH溶液的pH=10,可推知BOH溶液存在BOH?B++OH- | |
| D. | pH=2的一元酸和pH=12的一元强碱等体积混后溶液一定存在:c(OH-)=c(H+) |
分析 A.铝离子与碳酸氢根离子发生双水解反应;
B.pH=0的溶液中存在大量氢离子,硝酸根离子在酸性条件下能够氧化亚硫酸根离子;
C.0.1 mol/L的一元碱BOH溶液的pH=10,说明BOH在溶液中部分电离,为弱碱;
D.若酸为弱酸,混合液中酸过量,混合液呈酸性,则c(OH-)<c(H+).
解答 解:A.在pH=12的溶液中存在大量氢氧根离子,Al3+、HCO3-之间发生双水解反应,且二者都与氢氧根离子反应,在溶液中不能大量共存,故A错误;
B.常温下pH=0的溶液呈酸性,NO3-、SO32-在酸性条件下发生氧化还原反应,在溶液中不能大量共存,故B错误;
C.0.1 mol/L的一元碱BOH溶液的pH=10,说明BOH为弱碱,在溶液中部分电离,其电离方程式为:BOH?B++OH-,故C正确;
D.常温下pH=2的一元酸和pH=12的一元强碱等体积混后,若酸为强酸,则酸碱恰好中和,溶液呈中性:c(OH-)=c(H+);若酸为弱酸,酸过量,反应后溶液呈酸性,则c(OH-)<c(H+),故D错误;
故选C.
点评 本题考查了酸碱混合的定性判断及溶液pH的计算,题目难度中等,明确离子共存的条件为解答关键,注意掌握溶液酸碱性与溶液pH的关系,试题培养了学生的分析能力及逻辑推理能力.

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目
15.S2C12在工业上用作橡胶硫化剂.实验室利用下列装置(部分夹持仪器己略去),将干燥纯净的Cl2通入CS2液体中制备S2C12:CS2+3C12$\frac{\underline{\;95℃~100℃\;}}{\;}$CCl4+S2C12.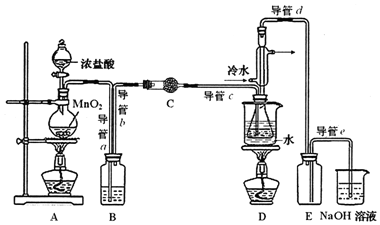
已知:
(1)该实验结束时熄灭酒精灯的操作顺序为:先⑥再②(用序号表示).
①通入C12 ②熄灭装置A中酒精灯 ③通入冷水④关闭冷水 ⑤加热装置D ⑥熄灭装置D中酒精灯
(2)为获得平缓稳定的Cl2气流,A装置的操作是控制分液漏斗下端的活塞,使浓盐酸匀速滴下.
(3)装置C中盛有的试剂是无水CaCl2(或P2O5);装置B中盛的试剂是饱和食盐水.
(4)装置D中冷凝管的作用是导气、冷凝回流;装置E的作用是防倒吸
(5)实验过程中,若缺少C装置,则产品浑浊不清并产生2种酸性气体,写出其反应的化学方程式2S2Cl2+2H2O═3S↓+SO2↑+4HCl↑.

已知:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| S | 113 | 444 | 1.96 | 不溶于水 |
| S2Cl2 | -76 | 138 | 1.75 | 与水反应 |
| CS2 | -109 | 47 | 1.26 | 不溶于水 |
| CCl4 | -23 | 77 | 1.59 | 不溶于水 |
①通入C12 ②熄灭装置A中酒精灯 ③通入冷水④关闭冷水 ⑤加热装置D ⑥熄灭装置D中酒精灯
(2)为获得平缓稳定的Cl2气流,A装置的操作是控制分液漏斗下端的活塞,使浓盐酸匀速滴下.
(3)装置C中盛有的试剂是无水CaCl2(或P2O5);装置B中盛的试剂是饱和食盐水.
(4)装置D中冷凝管的作用是导气、冷凝回流;装置E的作用是防倒吸
(5)实验过程中,若缺少C装置,则产品浑浊不清并产生2种酸性气体,写出其反应的化学方程式2S2Cl2+2H2O═3S↓+SO2↑+4HCl↑.
13.下列叙述的两个量,一定相等的是( )
| A. | 0.1mol•L-1NaNO3与0.05mol•L-1Na2CO3溶液中的Na+离子数目 | |
| B. | 质量相等的石墨和C60中的碳原子数目 | |
| C. | 标准状况下等体积的SO2与SO3的分子数目 | |
| D. | pH都为3的稀盐酸与AlCl3溶液中,由水电离产生的H+离子数目 |
20.下列关于含有NH4+溶液的叙述正确的是( )
| A. | 等浓度的下列溶液①(NH4)2CO3、②(NH4)2SO4、③(NH4)2FeSO4 ④NH3•H2O,NH4+浓度大小顺序: ④>③>②>① | |
| B. | PH值相同的①NH4Cl ②(NH4)2SO4 ③NH4HSO4三种溶液中,NH4+浓度大小顺序:③>②>① | |
| C. | 等浓度的①CH3COONH4 ②NH4HCO3 ③(NH4)2CO3PH大小关系:③>②>① | |
| D. | 等浓度等体积NH4Cl与NH3.H2O混合液的物量守恒:c(NH4+)+c(NH3.H2O)=c(Cl-) |
17.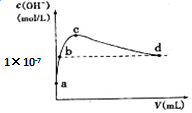 常温下,向1 L pH=10的NaOH溶液中持续通入CO2.通入CO2的体积(V)与溶液中水电离出的c(OH-)的关系如图所示.下列叙述不正确的是( )
常温下,向1 L pH=10的NaOH溶液中持续通入CO2.通入CO2的体积(V)与溶液中水电离出的c(OH-)的关系如图所示.下列叙述不正确的是( )
 常温下,向1 L pH=10的NaOH溶液中持续通入CO2.通入CO2的体积(V)与溶液中水电离出的c(OH-)的关系如图所示.下列叙述不正确的是( )
常温下,向1 L pH=10的NaOH溶液中持续通入CO2.通入CO2的体积(V)与溶液中水电离出的c(OH-)的关系如图所示.下列叙述不正确的是( )| A. | d点溶液中:c(Na+)═2c(CO32-)+c(HCO3-) | |
| B. | c点溶液中:c(Na+)>c(HCO3-)>c(CO32-) | |
| C. | b点溶液中:c(H+)=1×10-7mol•L-1 | |
| D. | a点溶液中:水电离出的c(H+)=1×10-10mol•L-1 |
15.下列有关元素及其化合物的叙述正确的是( )
| A. | Fe( OH)3胶体无色、透明,能发生丁达尔现象 | |
| B. | CO2通入CaCl2溶液中生成CaCO3沉淀 | |
| C. | 将稀硫酸滴加到Fe( NO3)2溶液中无明显现象 | |
| D. | H2、SO2、CO2三种气体都可以用浓硫酸干燥 |