题目内容
10.两种非金属元素X和Y,能分别形成常见气态氢化物Q和P,Q和P都是无色刺激性气味的气体,且都极易溶于水.常温常压下,Q的密度与空气的密度之比为0.59:1,标准状况下,P的密度为1.63g/L.Q与P能1:1化合生成盐M.(1)元素X在周期表中的位置为第2周期ⅤA族,Y的离子结构示意图为

(2)氢化物Q极易溶于水的主要原因是氨分子与水分子间存在氢键
(3)某化合物由氢元素与X、Y元素组成,分子式为XH2Y,在水中是一种缓释强效消毒剂,请用化学方程式表示其释放过程:NH2Cl+H2O?HClO+NH3或NH2Cl+2H2O?HClO+NH3•H2O
(4)某化合物由硼元素与X元素组成,化学式为BX,有多种结晶形态,其中立方结晶被认为是目前已知最硬的物质,该物质属于原子晶体.
分析 Q的密度与空气的密度之比为0.59:1,所以Q的相对分子量为0.59×29=17,所以Q是氨气,标准状况下,P的密度为1.63g/L,所以P的相对分子质量为:1.63g/L×22.4L/mol=37,所以气态氢化物P是HCl,Q与P能1:1化合生成盐M是氯化铵,所以X是氮、Y是氯元素,由此分析解答.
(1)根据N的核外电子排布确定其在元素周期表中的位置,根据氯离子的核外电子排布确定结构示意图;
(2)从形成分子间氢键对溶解度的影响的角度分析;
(3)XH2Y即为NH2Cl,与水发生水解反应,生成次氯酸和NH3•H2O;
(4)根据物理性质判断晶体类型.
解答 解:Q的密度与空气的密度之比为0.59:1,所以Q的相对分子量为0.59×29=17,所以Q是氨气,标准状况下,P的密度为1.63g/L,所以P的相对分子质量为:1.63g/L×22.4L/mol=37,所以气态氢化物P是HCl,Q与P能1:1化合生成盐M是氯化铵,所以X是氮、Y是氯元素.
(1)N的质子数是7,两个电子层,最外层5个电子,所以在周期表中的位置为第二周期ⅤA族,根据核外电子层排布,Cl-的结构示意图为: ,
,
故答案为:第二周期ⅤA族; ;
;
(2)氢化物Q是氨气,氨分子极易溶于水的主要原因是液氨分子与水分子间存在氢键,增大了溶解度,
故答案为:氨分子与水分子间存在氢键;
(3)某化合物由氢元素与X、Y元素组成,分子式为XH2Y,即为:NH2Cl,与水发生水解反应,方程式为:NH2Cl+H2O?HClO+NH3或NH2Cl+2H2O?HClO+NH3•H2O,
故答案为:NH2Cl+H2O?HClO+NH3或NH2Cl+2H2O?HClO+NH3•H2O;
(4)BN立方结晶被认为是目前已知最硬的物质,是因为B、N以共价键结合形成空间网状结构,因此BN的立方结晶属于原子晶体,
故答案为:原子.
点评 本题考查了位置、结构与性质关系的综合应用,题目难度中等,推断各元素名称为解答关键,注意氢键对物质物理性质的影响.

| A. | I2、Br2、Cl2 | B. | Na+、K+、Cs+ | C. | Cl-、Br-、I- | D. | Al3+、Mg2+、Na+ |
| A. | 标准状况下,2.24LCl2发生反应转移的电子数一定为0.2NA | |
| B. | 标准状况下,11.2L三氧化硫晶体含有的分子数为0.5NA | |
| C. | 标准状况下,3.36L氧气与3.2g硫反应,生成SO2分子数为0.1NA | |
| D. | 1L0.1mol/L的氨水中含OH-离子数为0.1NA |
| A. | 在pH=12的溶液中,Al3+、Cl-、HCO3-、Na+可以大量共存 | |
| B. | 在pH=0的溶液中,Na+、NO3-、SO32-、K+可以大量共存 | |
| C. | 由0.1 mol/L-元碱BOH溶液的pH=10,可推知BOH溶液存在BOH?B++OH- | |
| D. | pH=2的一元酸和pH=12的一元强碱等体积混后溶液一定存在:c(OH-)=c(H+) |
| A. | 某物质的溶液中由水电离出的c(H+)=1×10-amol/L,若a>7时,则该溶液的pH一定为14-a | |
| B. | 相同物质的量浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3•H2O;c(NH4+) 由大到小的顺序是:①>②>③>④ | |
| C. | 物质的量浓度相等的H2S和NaHS混合溶液中:c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-) | |
| D. | AgCl悬浊液中存在平衡:AgCl(s)?Ag+(aq)+Cl-(aq),往其中加入少量 NaCl粉末,平衡会向左移动,溶液中离子的总浓度会减小 |
| A. | 标准状况下,2.24LCCL4含有0.1NA个CCL4 | |
| B. | 7.8gNa2O2中所含阴离子的数目是0.1NA | |
| C. | 含NA个Na的Na2O溶解于1L水中,Na的物质的量浓度为1mol/L | |
| D. | 常温下,1LpH=1的CH4COOH溶液加水稀释后H+数目为0.1NA |
| A. | Na在空气中久置最终变为NaHCO3粉末 | |
| B. | 向Fe2(SO4)3溶液中加入铜粉,溶液变蓝且有黑色固体析出 | |
| C. | C12能与石灰乳反应,可用于制取漂白粉 | |
| D. | 向KC1O3溶液中滴加AgNO3溶液得到白色AgCl沉淀 |
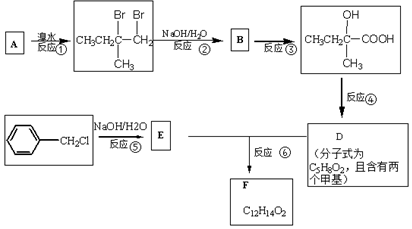
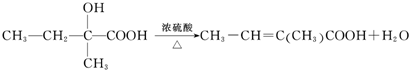 .
.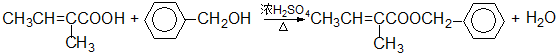 .
.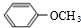 .
.