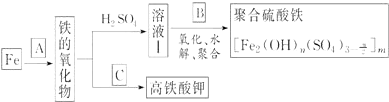
题目内容
9.1gH2燃烧生成液态水放出142.9kJ的热量,表示该反应的热化学方程式正确的是( )| A. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1 | |
| B. | 2H2(g)+O2(g)═2H2O(l)△H=-142.9kJ•mol-1 | |
| C. | 2H2(g)+O2(g)═2H2O (g)△H=-571.6kJ•mol-1 | |
| D. | 2H2(g)+O2(g)═2H2O (l)△H=+571.6kJ•mol-1 |
分析 2mol氢气的质量为:2g/mol×2mol=4g,1gH2燃烧生成液态水时放出142.9kJ的热量,则4g氢气完全燃烧生成液态水放出的热量为:142.9kJ×$\frac{4g}{1g}$=571.6kJ,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1,据此进行解答.
解答 解:2mol H2的质量为:2g/mol×2mol=4g,由于1gH2燃烧生成液态水时放出142.9kJ的热量,则4g氢气完全燃烧生成液态水放出的热量为:142.9kJ×$\frac{4g}{1g}$=571.6kJ,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1,
A.根据分析可知,氢气燃烧的热化学方程式为:2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1,故A正确;
B.2mol氢气放出的热量为571.6kJ,故B错误;
C.生成水的状态错误,应该为液态水,故C错误;
D.氢气的燃烧为放热反应,△H<0,故D错误;
故选A.
点评 本题考查了热化学方程式的书写方法,题目难度不大,明确热化学方程式的书写原则为解答关键,注意掌握反应热与焓变的关系,试题侧重考查学生的灵活应用能力.

练习册系列答案
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案
相关题目
9.下列各选项中的反应①与反应②不能用同一离子方程式表示的是( )
| 序号 | 反应① | 反应② |
| A | 向AgNO3溶液中滴加稀盐酸 | AgNO3溶液与食盐水混合 |
| B | 过量CO2通入NaOH溶液中 | 过量CO2通入澄清石灰水中 |
| C | 向烧碱溶液中滴加稀盐酸 | 向H2SO4溶液中滴加KOH溶液 |
| D | 向BaCl2溶液中滴加稀硫酸 | 向Ba(OH)2溶液中滴加CuSO4溶液 |
| A. | A | B. | B | C. | C | D. | D |
4.下列依据热化学方程式得出的结论正确的是( )
| A. | 已知2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1说明2molH2(g)和1molO2(g)的能量总和小于2molH2O(g)的能量 | |
| B. | 已知C(石墨,s)=C(金刚石,s);△H>0,则金刚石比石墨稳定 | |
| C. | 已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4kJ•mol-1,则含20gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量 | |
| D. | 已知2C(s)+2O2(g)═2CO2(g)△H1; 2C(s)+O2(g)=2CO(g)△H2;则△H1>△H2 |
1.设阿伏加德罗常数为NA.则下列说法正确的是( )
| A. | 1mol Cl2与常温下氢氧化钠溶液充分反应时转移的电子数为2NA | |
| B. | 1molCu与足量的硫固体反应转移的电子数为NA | |
| C. | 常温下,1 L 0.1 mol/L MgCl2溶液中含Mg2+数为0.1NA | |
| D. | 标准状况下,2.24L三氧化硫所含分子数为0.1 NA |
18.下列微粒中,属于阳离子的是( )
| A. | 11个质子,12个中子,10个电子 | B. | 18个质子,22个中子,18个电子 | ||
| C. | 16个质子,16个中子,18个电子 | D. | 17个质子,18个中子,17个电子 |
19.世界卫生组织对塑化剂DEHP(分子式为C24H38O4)规定的每日耐受摄入量为每千克0.025毫克,以体重为78kg的成人来讲,每天摄入1.95毫克及以下的DEHP是安全的.体重为78kg的成人每天摄入下列DEHP时,不安全的是(设NA为阿伏加德罗常数的值)( )
| A. | 5×10-6NA个DEHP分子 | |
| B. | 含有1.2×10-4NA个碳原子的DEHP分子 | |
| C. | 含有2×10-5NA个氧原子的DEHP分子 | |
| D. | 含有2.0×10-4NA个氢原子的DEHP分子 |