题目内容
10.0.4mol某气体的体积为9.8L,则该状况下的气体摩尔体积为24.5mol/L,气体所处的条件不是(填“是”或“不是”)标准状况.分析 该状况下气体摩尔体积=$\frac{V}{n}$,根据该状况下的气体摩尔体积与标况下的气体摩尔体积相对大小确定是否是标况下.
解答 解:该状况下气体摩尔体积=$\frac{V}{n}$=$\frac{9.8L}{0.4mol}$=24.5mol/L>22.4mol/L,所以该状况不是标准状况,故答案为:
24.5L.mol-1;不是.
点评 本题考查物质的量有关计算,为高频考点,明确各个物理量之间的关系式是解本题关键,气体摩尔体积受温度、压强影响,题目难度不大.

练习册系列答案
相关题目
18.NO和CO都是汽车尾气中的有害物质,它们能缓慢地起反应,反应的化学方程式为:2CO+2NO═N2+2CO2,为了控制大气污染,下列建议你认为可行的方法是( )
| A. | 使用催化剂 | B. | 改变压强 | ||
| C. | 适当提高反应温度 | D. | 将尾气点燃 |
5.下列关系的表述中,正确的是( )
| A. | 0.1mol•L-1NaHSO4溶液中:c(Na+)+c(H+)=c(SO42-)+c(OH-) | |
| B. | 中和pH和体积都相同的盐酸和醋酸,消耗NaOH的物质的量之比为1:1 | |
| C. | pH=3的盐酸和pH=3的FeCl3溶液中,由水电离出的c(H+)相等 | |
| D. | 0.1mol•L-1NaHCO3溶液中:c(Na+)>c(HCO3)>c(H2CO3)>c(CO32-) |
15.下列离子方程式正确的是( )
| A. | 向硫酸铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 少量双氧水滴入酸性KI溶液:2H2O2+2I-+4H+═4H2O+I2 | |
| C. | 磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O | |
| D. | 碱性锌锰电池正极反应:2MnO2+2H2O+2e-═2MnOOH+2OH- |
2.下列分散系属于胶体的是( )
| A. | 氯化钠溶液 | B. | 食盐水 | C. | 牛奶 | D. | 碘酒 |
19.下列离子方程式中,正确的是( )
| A. | 稀硫酸滴在铜片上:Cu+2H+═Cu2++H2O | |
| B. | 氧化镁与稀盐酸混合:MgO+2H+═Mg2++H2O | |
| C. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag | |
| D. | 稀硝酸滴在石灰石上:CaCO3+2H+═Ca2++H2CO3 |
9.某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取.
实验(一) 碘含量的测定
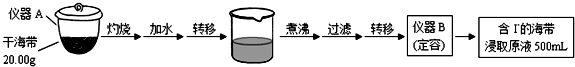
取0.0100mol•Lˉ1的AgNO3标准溶液装入滴定管,取100.00mL海带浸取原液至滴定池,用电势滴定法测定碘含量.测得的电动势(E)反映溶液中c(Iˉ)的变化,部分数据如下表:
实验(二) 碘的制取
另制海带浸取原液,甲、乙两种实验方案如下:
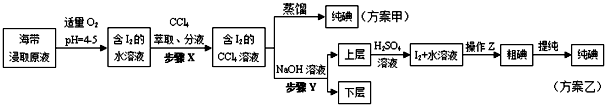
已知:3I2+6NaOH=5NaI+NaIO3+3H2O.
(1)实验(一) 中的仪器名称:仪器A坩埚,仪器B500mL容量瓶.
(2)①根据表中数据绘制滴定曲线:
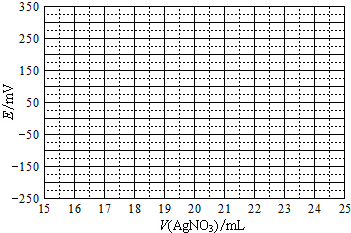
②该次滴定终点时用去AgNO3溶液的体积为20.00mL,计算得海带中碘的百分含量为0.635%.(已知碘的相对原子质量为127)
(3)①分液漏斗使用前须检漏,检漏方法为向分液漏斗中加入少量水,检查旋塞处是否漏水;将漏斗倒转过来,检查玻璃塞是否漏水.
②步骤X中,萃取后分液漏斗内观察到的现象是液体分上下两层,下层呈紫红色.
③下列有关步骤Y的说法,正确的是AB.
A.应控制NaOH溶液的浓度和体积 B.将碘转化呈离子进入水层
C.主要是除去海带浸取原液中的有机杂质 D.NaOH溶液可以由乙醇代替
④实验(二) 中操作Z的名称是过滤.
(4)方案甲中采用蒸馏不合理,理由是碘单质易升华,会导致碘损失.
实验(一) 碘含量的测定

取0.0100mol•Lˉ1的AgNO3标准溶液装入滴定管,取100.00mL海带浸取原液至滴定池,用电势滴定法测定碘含量.测得的电动势(E)反映溶液中c(Iˉ)的变化,部分数据如下表:
| V(AgNO3)/mL | 15.00 | 19.00 | 19.80 | 19.98 | 20.00 | 20.02 | 21.00 | 23.00 | 25.00 |
| E/mV | -225 | -200 | -150 | -100 | 50.0 | 175 | 275 | 300 | 325 |
另制海带浸取原液,甲、乙两种实验方案如下:

已知:3I2+6NaOH=5NaI+NaIO3+3H2O.
(1)实验(一) 中的仪器名称:仪器A坩埚,仪器B500mL容量瓶.
(2)①根据表中数据绘制滴定曲线:

②该次滴定终点时用去AgNO3溶液的体积为20.00mL,计算得海带中碘的百分含量为0.635%.(已知碘的相对原子质量为127)
(3)①分液漏斗使用前须检漏,检漏方法为向分液漏斗中加入少量水,检查旋塞处是否漏水;将漏斗倒转过来,检查玻璃塞是否漏水.
②步骤X中,萃取后分液漏斗内观察到的现象是液体分上下两层,下层呈紫红色.
③下列有关步骤Y的说法,正确的是AB.
A.应控制NaOH溶液的浓度和体积 B.将碘转化呈离子进入水层
C.主要是除去海带浸取原液中的有机杂质 D.NaOH溶液可以由乙醇代替
④实验(二) 中操作Z的名称是过滤.
(4)方案甲中采用蒸馏不合理,理由是碘单质易升华,会导致碘损失.
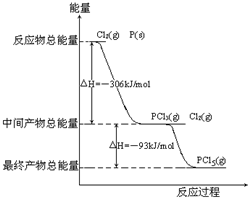 红磷P(s)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).根据如图回答下列问题:
红磷P(s)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).根据如图回答下列问题: