题目内容
15.钢铁发生电化学腐蚀时,负极上发生的反应是( )| A. | 2H2O+2e-═H2↑+2OH- | B. | O2+2H2O+4e-═4OH- | ||
| C. | Fe-2e-═Fe2+ | D. | 4OH--4e-═2H2O+O2↑ |
分析 钢铁发生电化学腐蚀时,负极上Fe失电子发生氧化反应,如果发生析氢腐蚀,则正极上生成氢气,如果发生吸氧腐蚀则正极上生成氢氧根离子,据此分析解答.
解答 解:钢铁发生电化学腐蚀时,负极上Fe失电子发生氧化反应,电极反应式为Fe-2e-═Fe2+;
如果发生析氢腐蚀,则正极上生成氢气,电极反应式为2H++2e-═H2↑;
如果发生吸氧腐蚀则正极上生成氢氧根离子,电极反应式为O2+2H2O+4e-═4OH-,
故选C.
点评 本题考查电极反应式的书写,为高频考点,明确各个电极上发生的反应是解本题关键,会根据电解质溶液酸碱性确定电极反应式,题目难度不大.

练习册系列答案
相关题目
11.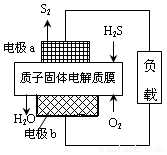 工业废气H2S经资源化利用后可回收能量并得到单质硫.反应原理为:2H2S(g)+O2(g)=S2(s)+2H2O(l)△H=-632kJ•mol-1.H2S燃料电池的工作原理如图所示.下列说法不正确的是( )
工业废气H2S经资源化利用后可回收能量并得到单质硫.反应原理为:2H2S(g)+O2(g)=S2(s)+2H2O(l)△H=-632kJ•mol-1.H2S燃料电池的工作原理如图所示.下列说法不正确的是( )
 工业废气H2S经资源化利用后可回收能量并得到单质硫.反应原理为:2H2S(g)+O2(g)=S2(s)+2H2O(l)△H=-632kJ•mol-1.H2S燃料电池的工作原理如图所示.下列说法不正确的是( )
工业废气H2S经资源化利用后可回收能量并得到单质硫.反应原理为:2H2S(g)+O2(g)=S2(s)+2H2O(l)△H=-632kJ•mol-1.H2S燃料电池的工作原理如图所示.下列说法不正确的是( )| A. | 电极a为电池的正极 | |
| B. | 电极b上发生的电极反应为O2+4H++4e-=2H2O | |
| C. | 若电路中通过2mol电子,则电池内部释放632kJ热能 | |
| D. | 若有17gH2S参与反应,则会有1molH+经质子膜进入正极区 |
6.2014年春,雾霾天气对环境造成了严重影响,部分城市开展PM2.5和臭氧的监测.下列有关说法正确的( )
| A. | 臭氧的摩尔质量是48g | |
| B. | 同温同压条件下,等质量的氧气和臭氧体积比为2:3 | |
| C. | 16g臭氧中含有6.02×1023个原子 | |
| D. | l.00mol臭氧中含有电子总数为18×6.02×1023个 |
3.下列有关化学用语表示正确的是( )
| A. | 乙烯的结构简式:C2H4 | |
| B. | 氢氧根离子的电子式: | |
| C. | 氯原子的结构示意图: | |
| D. | 中子数为146、质子数为92的铀(U)原子14692U |
7.已知:断裂下列化学键需要吸收的能量分别为:H-H 436kJ/mol;F-F 153kJ/mol;H-F 565kJ/mol.下列说法正确的是( )
| A. | H2与F2反应的热化学方程式为:H2(g)+F2(g)=2HF(g);△H=-541 kJ | |
| B. | 2 L HF气体分解成1 L H2和1 L F2吸收541 kJ的热量 | |
| C. | 在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量 | |
| D. | 1 mol H2与1 mol F2反应生成2 mol液态HF放出热量小于541 kJ |
4.下列有关铝及其化合物的性质叙述正确的是( )
| A. | 向氯化铝溶液中滴加过量氨水,最终得到澄清溶液 | |
| B. | 常温下铝、铁可以与盐酸分别反应生成Al Cl3和Fe Cl3 | |
| C. | 等质量的铝分别与足量的盐酸和足量的氢氧化钠溶液反应制得等质量的氢气 | |
| D. | Al Cl3溶液加热蒸干得到无水氯化铝晶体 |
5.下列关系的表述中,正确的是( )
| A. | 0.1mol•L-1NaHSO4溶液中:c(Na+)+c(H+)=c(SO42-)+c(OH-) | |
| B. | 中和pH和体积都相同的盐酸和醋酸,消耗NaOH的物质的量之比为1:1 | |
| C. | pH=3的盐酸和pH=3的FeCl3溶液中,由水电离出的c(H+)相等 | |
| D. | 0.1mol•L-1NaHCO3溶液中:c(Na+)>c(HCO3)>c(H2CO3)>c(CO32-) |
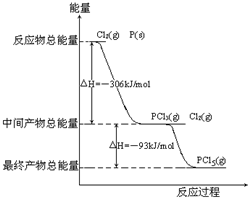 红磷P(s)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).根据如图回答下列问题:
红磷P(s)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).根据如图回答下列问题: