题目内容
2.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )| A. | 15g甲基(-CH3)所含有的电子数是10 NA个 | |
| B. | 标准状况下,2.24 L CHCl3的原子总数为0.5 NA个 | |
| C. | 4.2g C3H6中含有的碳碳双键数一定为0.1NA | |
| D. | 常温下,14g乙烯和丙烯的混合物中总原子数为3NA个 |
分析 A.甲基中含有9个电子,15g甲基的物质的量为1mol,含有9mol电子;
B.标准状况下CHCl3的状态不是气体;
C.C3H6分子中不一定含有碳碳双键;
D.乙烯和丙烯的最简式为CH2,根据最简式计算出含有原子的物质的量及数目.
解答 解:A.15g甲基(-CH3)的物质的量为:$\frac{15g}{15g/mol}$=1mol,1mol甲基中含有9mol电子,所含有的电子数是9 NA个,故A错误;
B.标准状况下,CHCl3不是气体,不能使用标准状况下的气体摩尔体积计算,故B错误;
C.C3H6可能为环丙烷,其分子中不一定含有碳碳双键,故C错误;
D.14g乙烯和丙烯的混合物中含有14g最简式CH2,含有最简式为物质的量为:$\frac{14g}{14g/mol}$=1mol,则混合物中含有原子的总物质的量为3mol,含有的总原子数为3NA个,故D正确;
故选D.
点评 本题考查阿伏加德罗常数的综合应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标准状况下气体摩尔体积的使用条件,试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
相关题目
12.下列关于氯的说法正确的是( )
| A. | Cl2具有很强的氧化性,在化学反应中只能作氧化剂 | |
| B. | 35Cl、37Cl为不同的核素,有不同的化学性质 | |
| C. | 实验室制备Cl2,不宜用排水法收集 | |
| D. | 铁丝在氯气燃烧生成氯化亚铁 |
13.归纳是学习化学的一种常用方法,某同学归纳的物质及其所属类別与右图的对应关系正确的是( )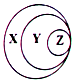

| A. | X-胶体 Y-混合物 Z-淀粉溶液 | B. | X-化合物 Y-含氧酸盐 Z-氯化钠 | ||
| C. | X-气态氢化物 Y-酸 Z-盐酸 | D. | X-强电解质 Y-强酸 Z-硫酸 |
10.常温常压下CO2、H2、CO的混合气体与氮气的密度相同,则该混合气体中CO2、H2、CO的质量之比可能为( )
| A. | 13:8:27 | B. | 13:9:27 | C. | 26:16:27 | D. | 286:8:27 |
7.下述实验能达到预期目的是编号( )
| 实验内容 | 实验目的 | |
| A | 向1mL 1%的NaOH溶液中加入2mL 2%的CuSO4溶液,振荡后再加入0.5mL有机物X,加热煮沸后未出现砖红色沉淀 | 验证X结构中不含有醛基 |
| B | 在混有少量苯酚的苯中滴加足量溴水,充分振荡后过滤 | 除去苯中少量的苯酚 |
| C | 溴乙烷与NaOH溶液加热至不再分层,冷却后加稀硝酸至酸性,再滴加AgNO3溶液 | 验证卤素原子为溴原子 |
| D | 将乙醇与浓硫酸共热制得的气体通入酸性KMnO4溶液中 | 检验气体中含有乙烯 |
| A. | A | B. | B | C. | C | D. | D |
11.下列叙述正确的是( )
| A. | 常温下,pH=3和pH=5的盐酸各10mL混合,所得溶液的pH=4 | |
| B. | 当温度不变时,在纯水中加入强碱溶液不会影响水的离子积常数 | |
| C. | 液氯虽然不导电,但溶解于水后导电情况良好,因此,液氯也是强电解质 | |
| D. | 溶液中c(H+)越大,pH也越大,溶液的酸性就越强 |
8.下列实验能达到预期目的是( )
| 实验内容 | 实验目的 | |
| A | 向某未知溶液中加人BaCl2溶液后,再加人稀硝酸观察沉淀的生成 | 检验是否含 SO42-离子 |
| B | 向某未知溶液中加人NaOH固体,加热,在管口用湿润的蓝色石蕊试纸检验 | 检验是否含NH4+离子 |
| C | 加热分别用SO2和HClO漂白后的品红溶液 | 探究SO2和HCIO漂白原理的不同 |
| D | 加热盛有浓硫酸和铜的试管 | 探究浓硫酸的脱水性 |
| A. | A | B. | B | C. | C | D. | D |

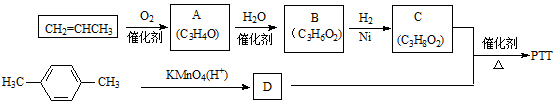

 ,反应类型为
,反应类型为