题目内容
7.X、Y、Z、W是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,己是由Z元素形成的单质.已知:甲+乙=丁+己,甲+丙=戊+己; 丁溶液为短周期元素中最高价氧化物对应水化物中碱性最强的物质.下列说法正确的是( )| A. | 原子半径:W>Z>Y>X | |
| B. | Y元素在周期表中的位置为第三周期第ⅣA族 | |
| C. | 1mol甲与足量的乙完全反应共转移了1mol电子 | |
| D. | 甲、乙、丙、丁、戊、己中含有的共价键的物质只有乙、丙、己 |
分析 丁溶液为短周期元素中最高价氧化物对应水化物中碱性最强的物质,则丁为NaOH,发生反应:甲+乙=丁+己,根据元素守恒可知,甲、乙两种物质至少共含有H、O、Na元素,己是由Z组成的单质,由发生反应可知,己不能是Na,结合原子序数可知,X为H、Z为O、W为Na元素,故己为氧气,可知甲是Na2O2、乙是水,再根据反应:甲+丙=戊+己,可知丙是二氧化碳,戊是碳酸钠,则Y为C,结合对应单质、化合物的性质以及题目要求可解答该题.
解答 解:丁溶液为短周期元素中最高价氧化物对应水化物中碱性最强的物质,则丁为NaOH,发生反应:甲+乙=丁+己,根据元素守恒可知,甲、乙两种物质至少共含有H、O、Na元素,己是由Z组成的单质,由发生反应可知,己不能是Na,结合原子序数可知,X为H、Z为O、W为Na元素,故己为氧气,可知甲是Na2O2、乙是水,再根据反应:甲+丙=戊+己,可知丙是二氧化碳,戊是碳酸钠,则Y为C.
A.同周期随原子序数增大原子半径减小,同主族自上而下原子半径增大,H原子半径最小,则原子半径大小顺序为:Na>C>O>H,即:W>Y>Z>X,故A错误;
B.Y为碳,在周期表中的位置为:第二周期第ⅣA族,故B错误;
C.甲与足量的乙完全反应的方程式为:2Na2O2+2H2O═4NaOH+O2↑,反应中过氧化钠其氧化剂、还原剂作用,各占一半,故1molNa2O2反应转移的电子为1mol×$\frac{1}{2}$×2=1mol,故C正确;
D.过氧化钠、水、二氧化碳、氢氧化钠、碳酸钠、氧气中均含有共价键,故D错误.
故选:C.
点评 本题考查元素化合物推断,题目难度中等,丁溶液碱性是推断突破口,需要学生熟练掌握元素化合物知识,对学生的逻辑推理有一定的要求.

练习册系列答案
相关题目
17.化学式为C5H12O且能与钠反应的同分异构体有( )
| A. | 6种 | B. | 7种 | C. | 8种 | D. | 9种 |
18.下列混合物可以用分液漏斗分离的是( )
| A. | 溴乙烷和水 | B. | 汽油和苯 | C. | 乙醇和水 | D. | 溴苯和苯 |
12.食盐(NaCl)是生活中常用的调味品,HCl是胃酸的主要成分,下列关于这两种物质的说法正确的是( )
| A. | 炒菜时放入食盐并不破坏NaCl中的离子键 | |
| B. | HCl的电子式是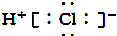 | |
| C. | HCl是共价化合物,但溶于水时电离出H+和Cl- | |
| D. | NaCl熔化时破坏共价键 |
19.能将直馏汽油、裂化汽油、乙醇、四氯化碳四种液体鉴别出来的试剂是( )
| A. | 水 | B. | AgNO3溶液 | C. | 高锰酸钾 | D. | 溴水 |
16.下列关于同分异构体数目的叙述不正确的是( )
| A. | 甲苯苯环上的1个氢原子被含3个碳原子的烷基取代,所得产物有6种 | |
| B. | 已知丙烷的二氯代物有4种异构体,则其六氯代物的异构体数目也为4种 | |
| C. | 含有5个碳原子的某饱和链烃,其一氯代物有3种 | |
| D. | 菲的结构为 ,它与硝酸反应,可生成5种一硝基取代物 ,它与硝酸反应,可生成5种一硝基取代物 |
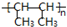 .
. .
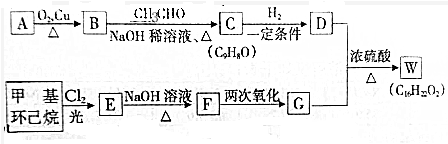
.
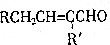 +H2O(R、R′为H或烃基)
+H2O(R、R′为H或烃基)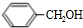 ;C中含有的官能团为碳碳双键、醛基(写名称).
;C中含有的官能团为碳碳双键、醛基(写名称).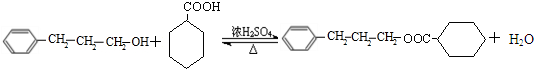 .
.