题目内容
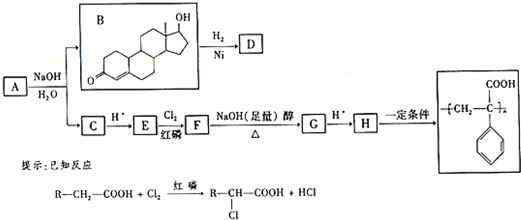
A、B、C、D、E、F、G都是链状有机物,它们的转化关系如图1所示,A为含有四个相同卤原子的卤代烃且分子中无甲基,D的相对分子质量与E相差42,请回答下列问题;
(1)A的分子式为 A和E的官能团名称分别是 , .
(2)D的核磁共振氢谱图上有3个峰,且峰面积之比为1:3:6,请写出D的结构简式 .
(3)写出B生成C的化学方程式 .
(4)芳香族化合物H与G互为同分异构体,1molH与足量氢氧化钠溶液反应消耗2molNaOH,且1molH最多消耗3molNa,若H苯环上的一氯代物只有两种,写出所有符合条件的H的结构简式: .
(5)2012年11月,酒鬼酒、茅台、五粮液等白酒均被曝塑化剂含量严重超标,塑化剂成份其中一种为邻苯二甲酸二丁酯(DBP),其结构右如图2所示,则DBP虚线框外的原子团异构所形成的异构体数为 种.
(1)A的分子式为
(2)D的核磁共振氢谱图上有3个峰,且峰面积之比为1:3:6,请写出D的结构简式
(3)写出B生成C的化学方程式
(4)芳香族化合物H与G互为同分异构体,1molH与足量氢氧化钠溶液反应消耗2molNaOH,且1molH最多消耗3molNa,若H苯环上的一氯代物只有两种,写出所有符合条件的H的结构简式:
(5)2012年11月,酒鬼酒、茅台、五粮液等白酒均被曝塑化剂含量严重超标,塑化剂成份其中一种为邻苯二甲酸二丁酯(DBP),其结构右如图2所示,则DBP虚线框外的原子团异构所形成的异构体数为

考点:有机物的推断,同分异构现象和同分异构体
专题:有机物的化学性质及推断
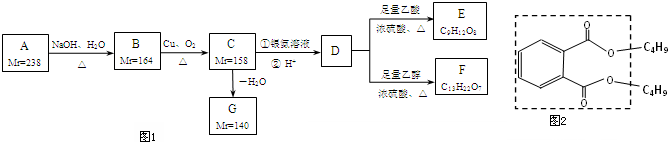
分析:由转化关系可知,A在NaOH水溶液、加热条件下生成B,B在Cu、氧气加热条件下生成C,故B为醇,则C含有-CHO或羰基,C氧化生成D,D能与乙酸、乙醇反应,故D含有羧基-COOH、羟基-OH,故B中含有不能被氧化的-OH,由B、C的相对分子质量可知,B中能被氧化的-OH数目为(164-158)÷2=3,故B中至少含有4个-OH.由E、F中C原子数目可知,D中-COOH比-OH多2个,由F中氧原子可知D中最多有3个-COOH,故D中含有3个-COOH、1个-OH,故D中含有7个碳原子,C中含有3个-CHO、1个-OH,由转化关系可知B、C、D中碳原子数目相等,都为7个,故C中剩余基团的式量为158-17-29×3-12×(7-3)=6,故C中还含有6个H原子,C的分子式为C7H10O4,C氧化为D,-CHO转化为-COOH,故D为C7H10O7,D分子中不含甲基,D的核磁共振氢谱图上有3个峰,且峰面积之比为1:3:6,故D的结构简式为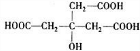 ,逆推可得C的结构简式为
,逆推可得C的结构简式为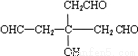 、B为
、B为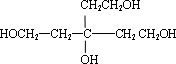 ,故G为
,故G为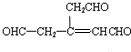 ,E为
,E为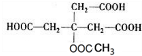 ,F为
,F为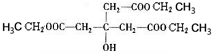 .A为含有四个相同卤原子的卤代烃且分子中无甲基,A分子中只含有一种官能团,水解引入-OH得到B,将-OH还原为A中的基团(或原子),令A中代替-OH的基团(或原子)式量为a,则4a+(164-4×17)=238,解得a=35.5,故为Cl原子,则A为
.A为含有四个相同卤原子的卤代烃且分子中无甲基,A分子中只含有一种官能团,水解引入-OH得到B,将-OH还原为A中的基团(或原子),令A中代替-OH的基团(或原子)式量为a,则4a+(164-4×17)=238,解得a=35.5,故为Cl原子,则A为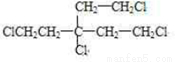 ,据此解答.
,据此解答.
 ,逆推可得C的结构简式为
,逆推可得C的结构简式为 、B为
、B为 ,故G为
,故G为 ,E为
,E为 ,F为
,F为 .A为含有四个相同卤原子的卤代烃且分子中无甲基,A分子中只含有一种官能团,水解引入-OH得到B,将-OH还原为A中的基团(或原子),令A中代替-OH的基团(或原子)式量为a,则4a+(164-4×17)=238,解得a=35.5,故为Cl原子,则A为
.A为含有四个相同卤原子的卤代烃且分子中无甲基,A分子中只含有一种官能团,水解引入-OH得到B,将-OH还原为A中的基团(或原子),令A中代替-OH的基团(或原子)式量为a,则4a+(164-4×17)=238,解得a=35.5,故为Cl原子,则A为 ,据此解答.
,据此解答.解答:
解:由转化关系可知,A在NaOH水溶液、加热条件下生成B,B在Cu、氧气加热条件下生成C,故B为醇,则C含有-CHO或羰基,C氧化生成D,D能与乙酸、乙醇反应,故D含有羧基-COOH、羟基-OH,故B中含有不能被氧化的-OH,由B、C的相对分子质量可知,B中能被氧化的-OH数目为(164-158)÷2=3,故B中至少含有4个-OH.由E、F中C原子数目可知,D中-COOH比-OH多2个,由F中氧原子可知D中最多有3个-COOH,故D中含有3个-COOH、1个-OH,故D中含有7个碳原子,C中含有3个-CHO、1个-OH,由转化关系可知B、C、D中碳原子数目相等,都为7个,故C中剩余基团的式量为158-17-29×3-12×(7-3)=6,故C中还含有6个H原子,C的分子式为C7H10O4,C氧化为D,-CHO转化为-COOH,故D为C7H10O7,D分子中不含甲基,D的核磁共振氢谱图上有3个峰,且峰面积之比为1:3:6,故D的结构简式为 ,逆推可得C的结构简式为
,逆推可得C的结构简式为 、B为
、B为 ,故G为
,故G为 ,E为
,E为 ,F为
,F为 .A为含有四个相同卤原子的卤代烃且分子中无甲基,A分子中只含有一种官能团,水解引入-OH得到B,将-OH还原为A中的基团(或原子),令A中代替-OH的基团(或原子)式量为a,则4a+(164-4×17)=238,解得a=35.5,故为Cl原子,则A为
.A为含有四个相同卤原子的卤代烃且分子中无甲基,A分子中只含有一种官能团,水解引入-OH得到B,将-OH还原为A中的基团(或原子),令A中代替-OH的基团(或原子)式量为a,则4a+(164-4×17)=238,解得a=35.5,故为Cl原子,则A为 ,
,
(1)A为 ,分子式为C7H12Cl4,含有的官能团为氯原子,E为
,分子式为C7H12Cl4,含有的官能团为氯原子,E为 ,含有的官能团为羧基、酯基,故答案为:C7H12Cl4;氯原子;羧基、酯基;
,含有的官能团为羧基、酯基,故答案为:C7H12Cl4;氯原子;羧基、酯基;
(2)由上述分析可知,D的结构简式为 ,故答案为:
,故答案为: ;
;
(3)B生成C的化学方程式为: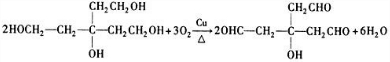 ,故答案为:
,故答案为: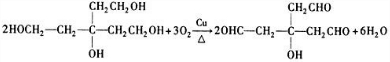 ;
;
(4)芳香族化合物H与G( )互为同分异构体,G的不饱和度为4,故H含有1个苯环,侧链不存在不饱和键,1molH与足量氢氧化钠溶液反应消耗2molNaOH,且1molH最多消耗3molNa,则H分子含有2故酚羟基、1个醇羟基,若H苯环上的一氯代物只有两种,所有符合条件的H的结构简式为:
)互为同分异构体,G的不饱和度为4,故H含有1个苯环,侧链不存在不饱和键,1molH与足量氢氧化钠溶液反应消耗2molNaOH,且1molH最多消耗3molNa,则H分子含有2故酚羟基、1个醇羟基,若H苯环上的一氯代物只有两种,所有符合条件的H的结构简式为:
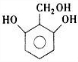 、
、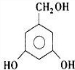 ,故答案为:
,故答案为: 、
、 .
.
(5)邻苯二甲酸二丁酯(DBP)虚线框外的原子团为丁基,丁基有-CH2CH2CH2CH3、-CH(CH3)CH2CH3、-CH2CH(CH3)2、-C(CH3)3,若丁基相同时,有4种结构,若丁基不同时,为任意两个组合,有6种,故丁基异构所形成的异构体数为10种,故答案为:10.
 ,逆推可得C的结构简式为
,逆推可得C的结构简式为 、B为
、B为 ,故G为
,故G为 ,E为
,E为 ,F为
,F为 .A为含有四个相同卤原子的卤代烃且分子中无甲基,A分子中只含有一种官能团,水解引入-OH得到B,将-OH还原为A中的基团(或原子),令A中代替-OH的基团(或原子)式量为a,则4a+(164-4×17)=238,解得a=35.5,故为Cl原子,则A为
.A为含有四个相同卤原子的卤代烃且分子中无甲基,A分子中只含有一种官能团,水解引入-OH得到B,将-OH还原为A中的基团(或原子),令A中代替-OH的基团(或原子)式量为a,则4a+(164-4×17)=238,解得a=35.5,故为Cl原子,则A为 ,
,(1)A为
 ,分子式为C7H12Cl4,含有的官能团为氯原子,E为
,分子式为C7H12Cl4,含有的官能团为氯原子,E为 ,含有的官能团为羧基、酯基,故答案为:C7H12Cl4;氯原子;羧基、酯基;
,含有的官能团为羧基、酯基,故答案为:C7H12Cl4;氯原子;羧基、酯基;(2)由上述分析可知,D的结构简式为
 ,故答案为:
,故答案为: ;
;(3)B生成C的化学方程式为:
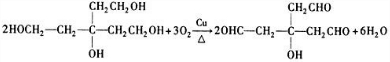 ,故答案为:
,故答案为: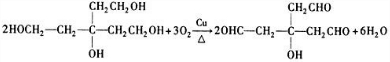 ;
;(4)芳香族化合物H与G(
 )互为同分异构体,G的不饱和度为4,故H含有1个苯环,侧链不存在不饱和键,1molH与足量氢氧化钠溶液反应消耗2molNaOH,且1molH最多消耗3molNa,则H分子含有2故酚羟基、1个醇羟基,若H苯环上的一氯代物只有两种,所有符合条件的H的结构简式为:
)互为同分异构体,G的不饱和度为4,故H含有1个苯环,侧链不存在不饱和键,1molH与足量氢氧化钠溶液反应消耗2molNaOH,且1molH最多消耗3molNa,则H分子含有2故酚羟基、1个醇羟基,若H苯环上的一氯代物只有两种,所有符合条件的H的结构简式为: 、
、 ,故答案为:
,故答案为: 、
、 .
.(5)邻苯二甲酸二丁酯(DBP)虚线框外的原子团为丁基,丁基有-CH2CH2CH2CH3、-CH(CH3)CH2CH3、-CH2CH(CH3)2、-C(CH3)3,若丁基相同时,有4种结构,若丁基不同时,为任意两个组合,有6种,故丁基异构所形成的异构体数为10种,故答案为:10.
点评:本题考查有机物推断,需要学生充分利用分子式、相对原子质量综合分析各物质含有的官能团、C原子数目等进行推断,难度较大.

练习册系列答案
相关题目
在一个体积不变的密闭容器中,盛有等物质的量的SO2、O2、SO3(气)的混合气体,在一定温度和压强下,反应达平衡时,容器中混合气体的密度比反应前减少了
(温度、压强反应前后不变),则反应达平衡时,混和气体中SO2占总体积的( )
| 1 |
| 13 |
A、
| ||
B、
| ||
C、
| ||
D、
|
用18O标记的CH3CH218OH与乙酸反应制取乙酸乙酯,下列有关说法不正确的是( )
| A、产物乙酸乙酯存在18O |
| B、产物水中存在18O |
| C、反应中加入浓硫酸作催化剂 |
| D、此反应属于取代反应 |
如图,关闭活塞K,向A中充入1molX、1molY,向B中充入2molX、2molY,此时A的容积是a L,B的容积是2aL.在相同温度和催化剂存在的条件下,使两容器中各自发生下述反应:X(g)+Y(g)?2Z(g)+W(g);△H<0.A保持恒压,B保持恒容,达平衡时,A的体积为1.4a L.下列说法错误的是( )


| A、反应速率:v(B)>v(A) |
| B、A 容器中X的转化率为80% |
| C、若打开K,则A的体积变为2.6a L |
| D、平衡时Y的体积分数:A<B |
有一分子式为C5H10N2O3的二肽,经水解得到甘氨酸(氨基乙酸)和另一种氨基酸X,则X的分子式为( )
| A、C3H7NO2 |
| B、C3H8NO3 |
| C、C3H7N2O2 |
| D、C3H8NO3 |