题目内容
5. 实验室用氯化钠固体配制1.00mol/L的NaCl溶液500mL,回答下列问题:
实验室用氯化钠固体配制1.00mol/L的NaCl溶液500mL,回答下列问题:(1)请补充完整该实验的实验步骤:
①计算;②称量NaCl固体29.3 g;③溶解;④移液;⑤洗涤;⑥定容;⑦摇匀.
(2)本实验用到的基本仪器已有烧杯、天平(带砝码)、药匙、量筒、玻璃棒,还缺少的仪器是500ml容量瓶、胶头滴管.
(3)如图是该同学转移溶液的示意图,图中有两处错误,请写出:①应用500ml容量瓶;②移液时未用玻璃棒引流.
(4)在配制过程中,下列操作会引起浓度偏小的是ABCF(可多选).
A.在烧杯中溶解溶质,搅拌时不慎溅出少量溶液
B.未将洗涤烧杯内壁和玻璃棒的溶液转移入容量瓶
C.定容后塞上瓶塞反复摇匀,静置后,发现液面低于刻度线,在加水至刻度线
D.将配得的溶液从容量瓶转移到干燥、洁净的试剂瓶中时,有少量溅出
E.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水
F.容量瓶中液面将达到刻度线时,仰视刻度线.
分析 (1)根据溶液的配制原理可知,用固体配制溶液的一般步骤为计算、称量、溶解转移、洗涤转移、定容摇匀;
(2)根据配制一定物质的量浓度的溶液的具体操作步骤,选择所需的仪器;
(3)依据容量瓶的构造及使用方法解答;
(4)根据c=$\frac{n}{V}$分析操作对溶质的物质的量或对溶液的体积的影响判断.
解答 解:(1)m=nM=CVM=1.00mol/L×0.5L×58.5=29.25g≈29.3g,根据溶液的配制原理可知,用固体配制溶液的一般步骤为计算、称量29.3g、溶解、移液、洗涤、定容、摇匀;
故答案为:29.3;溶解;洗涤;定容;
(2)称量需用药匙取氯化钠,溶解需要用烧杯,玻璃棒搅拌,移液用到500ml容量瓶,转移过程中用玻璃棒引流,最后用胶头滴管定容.
故还需仪器为500mL容量瓶、胶头滴管;
故答案为:500mL容量瓶;胶头滴管;
(3)配置500mLNaCl溶液应选择500ml容量瓶;容量瓶颈比较细,向容量瓶中转移液体时,要用玻璃棒来引流;
故答案为:应用500ml容量瓶;移液时未用玻璃棒引流;
(4)依据C=$\frac{n}{V}$分析,凡是能够使n偏小或者使V偏大的操作都会使溶液的浓度偏小,反之,溶液的浓度偏大;
A.在烧杯内溶解溶质,搅拌时不慎溅出少量溶液,导致溶质的物质的量n偏小,溶液的浓度偏低,故A正确;
B.未将洗涤烧杯内壁的溶液转移入容量瓶,导致部分溶质部分损耗,溶质的物质的量偏小,溶液浓度偏小,故B正确;
C.定容后塞上瓶塞反复摇匀,静置后,发现液面低于刻度线,在加水至刻度线,导致溶液体积偏大,溶液浓度偏低,故C正确;
D.将配得的溶液从容量瓶转移到干燥、洁净的试剂瓶中时,有少量溅出,无影响,故溶液的浓度不变,故D错误;
E.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水,无影响,故溶液的浓度不变,故E错误;
F.将容量瓶中液面将达到刻度线时,仰视刻度线和液面,导致溶液体积偏大,溶液浓度偏低,故F正确,
故答案为:ABCF.
点评 本题考查了一定物质的量浓度溶液的配制及误差分析,明确配制原理和实验步骤是解题关键,题目难度不大.

| A. | 中子数为8的氮原子:${\;}_{8}^{15}$N | |
| B. | 次氯酸的电子式: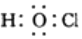 | |
| C. | PCl5分子的每个原子都满足8电子稳定结构 | |
| D. | 用电子式表示NaCl的形成过程: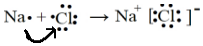 |
| A. | 蛋白质溶液中加入Na2SO4可使其变性 | |
| B. | 蔗糖水解生成互为同分异构体的葡萄糖和果糖 | |
| C. | 顺-2一丁烯和反-2-丁烯的加氢产物不同 | |
| D. | 石油的分馏和煤的于馏均属于化学变化 |
| A. | 常温下,苯酚易溶于水 | |
| B. | 苯酚俗称石炭酸,具有微弱的酸性,能与碳酸钠溶液反应 | |
| C. | 能与FeCl3溶液作用显紫色的有机物一般含有酚羟基 | |
| D. | 洒落皮肤上的苯酚可以用氢氧化钠稀溶液洗涤 |
| 实验 | 现象 | 结论 | |
| A | 室温下测0.1mol•L-1醋酸pH | pH≈3.3 | 醋酸是弱酸 |
| B | 向2mL 0.1mol•L-1NaOH溶液中 i.滴加几滴同浓度的MgSO4溶液 ii.再滴加几滴同浓度FeCl3溶液 | i.产生白色沉淀 ii.产生红褐色沉淀 | 溶解度:Fe(OH)3<Mg(OH)2 |
| C | 常温下,将CO2通入苯酚钠溶液中 | 溶液变浑浊 | 酸性:碳酸>苯酚 |
| D | 将少量溴乙烷与NaOH溶液共热,冷却、HNO3酸化后,滴加AgNO3溶液 | 淡黄色沉淀 | 证明含有溴元素 |
| A. | A | B. | B | C. | C | D. | D |
| 实验步骤 | 有关问题 |
| (1)计算所需Na2CO3的质量 | 需要Na2CO3的质量为10.6g. |
| (2)称量Na2CO3固体 | 称量过程中主要用到的仪器是托盘天平、砝码、药匙. |
| (3)将Na2CO3加入100mL烧杯中 | 为加快溶解速率,可采取的措施是用玻棒搅拌或加热 |
| (4)将烧杯中的溶液转移至500mL容量瓶中 | 为防止溶液溅出,应采取的措施是用玻璃棒引流 |
| (5)向容量瓶中加蒸馏水至刻度线 | 在进行此操作时应注意的问题是当加水璃刻度线1-2cm时改用胶头璃管加水至凹液面与刻度线相切 |
| A. | 48 mol•(L•s )-1 | B. | 36 mol•(L•s )-1 | C. | 24 mol•(L•s )-1 | D. | 12 mol•(L•s )-1 |
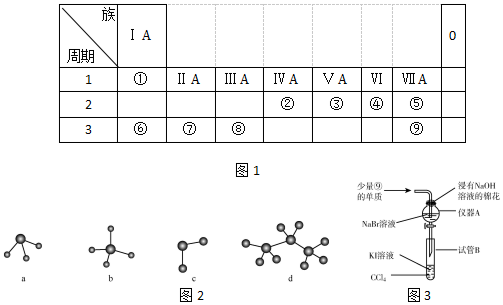
 .
. →
→ ,元素⑥和⑨形成的化合物中含有离子键.
,元素⑥和⑨形成的化合物中含有离子键.