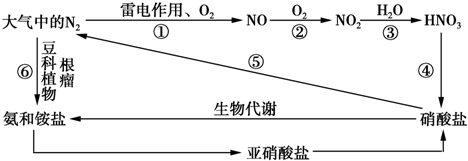
题目内容
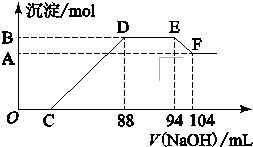 实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.现有一定量铝粉和铁粉的混合物与一定体积某浓度的稀硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入5mol?L-1的NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量关系如图所示.则
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.现有一定量铝粉和铁粉的混合物与一定体积某浓度的稀硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入5mol?L-1的NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量关系如图所示.则(1)B与A的差值为
(2)原硝酸溶液中含硝酸的物质的量为
(3)铝粉和铁粉的混合物中铝粉与铁粉的物质的量之比为
(4)写出铝与该浓度硝酸反应的离子方程式
考点:离子方程式的有关计算
专题:计算题
分析:通过题意,反应始终没有气体生成,可以得出不会有氮的氧化物生成,又有硝酸的浓度越稀,对应还原产物中氮元素的化合价越低,可以推测N元素由+5变成了-3价,由图可得硝酸过量,加入氢氧化钠溶液应先与硝酸反应,再生成沉淀,当沉淀完全后由图知继续加入氢氧化钠溶液,沉淀量不变,可得与NH4+发生了反应,
(1)可根据Al(OH)3 +OH-=AlO2-+2H2O.得出Al(OH)3的物质的量;
(2)根据N元素守恒计算硝酸的物质的量;
(3)Al(OH)3的物质的量为0.05mol,根据铝元素守恒,n(Al)=0.05mol,根据电子转移守恒求得n(Fe)=0.03mol,据此求出混合物中铝粉与铁粉的物质的量之比;
(4)根据以上分析可知,n(Al)=0.05mol,n(NH4+)=0.03mol,金属与硝酸反应时,硝酸的还原产物为NH4NO3,根据氧化还原反应守恒书写.
(1)可根据Al(OH)3 +OH-=AlO2-+2H2O.得出Al(OH)3的物质的量;
(2)根据N元素守恒计算硝酸的物质的量;
(3)Al(OH)3的物质的量为0.05mol,根据铝元素守恒,n(Al)=0.05mol,根据电子转移守恒求得n(Fe)=0.03mol,据此求出混合物中铝粉与铁粉的物质的量之比;
(4)根据以上分析可知,n(Al)=0.05mol,n(NH4+)=0.03mol,金属与硝酸反应时,硝酸的还原产物为NH4NO3,根据氧化还原反应守恒书写.
解答:
解:(1)可根据Al(OH)3 +OH-=AlO2-+2H2O,得出Al(OH)3的物质的量为(104-94)×10-3L×5mol/L=0.05 mol,故答案为:0.05;
(2)根据N元素守恒,可知:n(HNO3)=n(H+)+2n(NH4NO3)+3n(Fe(NO3)3)+3n(Al(NO3)3)=0.04L×5mol/L+2×0.03mol+3×0.08mol=0.5mol,
故答案为:0.5;
(3)Al(OH)3的物质的量为0.05mol,根据铝元素守恒,故混合金属中n(Al)=0.05mol,由图可知,DE段消耗的氢氧化钠的体积为94mL-88mL=6mL,故该阶段参加反应的氢氧化钠为0.006L×5mol/L=0.03mol,根据NH4++OH-═NH3?H2O 可知,计算溶液中n(NH4+)=0.03ml,根据电子转移守恒有,3n(Fe)+3n(Al)=8n(NH4+),即3n(Fe)+3×0.05mol=8×0.03mol,解得n(Fe)=0.03mol,混合金属中n(Al)=0.05mol、n(Fe)=0.03mol,样品中铝粉和铁粉的物质的量之比为5:3,
故答案为:5:3;
(4)由题意知,金属与硝酸反应时,硝酸的还原产物为NH4NO3,根据氧化还原反应得失电子守恒和电荷守恒,离子反应为:8Al+30H++3NO3-=8Al3++3NH4++9H2O,
故答案为:8Al+30H++3NO3-=8Al3++3NH4++9H2O.
(2)根据N元素守恒,可知:n(HNO3)=n(H+)+2n(NH4NO3)+3n(Fe(NO3)3)+3n(Al(NO3)3)=0.04L×5mol/L+2×0.03mol+3×0.08mol=0.5mol,
故答案为:0.5;
(3)Al(OH)3的物质的量为0.05mol,根据铝元素守恒,故混合金属中n(Al)=0.05mol,由图可知,DE段消耗的氢氧化钠的体积为94mL-88mL=6mL,故该阶段参加反应的氢氧化钠为0.006L×5mol/L=0.03mol,根据NH4++OH-═NH3?H2O 可知,计算溶液中n(NH4+)=0.03ml,根据电子转移守恒有,3n(Fe)+3n(Al)=8n(NH4+),即3n(Fe)+3×0.05mol=8×0.03mol,解得n(Fe)=0.03mol,混合金属中n(Al)=0.05mol、n(Fe)=0.03mol,样品中铝粉和铁粉的物质的量之比为5:3,
故答案为:5:3;
(4)由题意知,金属与硝酸反应时,硝酸的还原产物为NH4NO3,根据氧化还原反应得失电子守恒和电荷守恒,离子反应为:8Al+30H++3NO3-=8Al3++3NH4++9H2O,
故答案为:8Al+30H++3NO3-=8Al3++3NH4++9H2O.
点评:本题考查混合物的计算,题目难度较大,本题注意根据图象判断各阶段反应的情况,由图可得硝酸过量,加入氢氧化钠溶液应先与硝酸反应,再生成沉淀,当沉淀完全后由图知继续加入氢氧化钠溶液,沉淀量不变,注意从质量守恒的角度结合反应的关系式计算.

练习册系列答案
相关题目
将一定质量的铁、铜组成的混合物9.90g加入到稀硝酸中,金属完全溶解(假设反应中还原产物全部是NO).向反应后的溶液中加入6mol/LNaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加到17.55g,则下列叙述中正确的是( )
| A、当金属全部溶解时收集到NO气体的体积为3.36L |
| B、当金属全部溶解时,无法计算参加反应的硝酸的物质的量 |
| C、将生成的沉淀加热灼烧,可能得到FeO、Fe2O3和CuO的混合物 |
| D、当生成沉淀达到最大量时,消耗NaOH溶液的体积为V≥75ml |
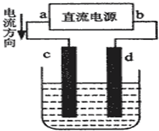 如图是电解CuCl2溶液的装置,其中c、d为石墨电极.则下列有关的判断正确的是( )
如图是电解CuCl2溶液的装置,其中c、d为石墨电极.则下列有关的判断正确的是( )| A、a为负极、b为正极 |
| B、电解过程中,c电极发生还原反应 |
| C、电解过程中,d电极质量增加 |
| D、电解过程中,氯离子浓度不变 |
 现有一定质量的某种碱金属的两种碳酸盐(正盐和酸式盐)组成的混合物加水溶解后向其中所得溶液逐滴加入一定浓度的稀盐酸,并同时记录放出二氧化碳气体的体积(标准状况)和消耗盐酸的体积,得到如图所示的曲线.下列说法不正确的是( )
现有一定质量的某种碱金属的两种碳酸盐(正盐和酸式盐)组成的混合物加水溶解后向其中所得溶液逐滴加入一定浓度的稀盐酸,并同时记录放出二氧化碳气体的体积(标准状况)和消耗盐酸的体积,得到如图所示的曲线.下列说法不正确的是( )| A、由图可知正盐和酸式盐的物质的量之比为3:2 |
| B、由图可知含正盐物质的量为0.003mol |
| C、盐酸的浓度为0.25mol/L |
| D、两种盐的总物质的量为0.05mol |
 如图为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
如图为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )| A、常压下五种元素的单质中,Z单质的熔点最高 |
| B、Z2水溶液中通入YO2后褪色,表现了YO2的漂白性 |
| C、工业上合成X的氢化物采用高温高压催化剂条件 |
| D、Y、Z的阴离子电子层结构都与R原子的相同 |
两种金属混合粉末12克,与足量盐酸反应时生成标准状况下11.2L氢气,符合上述情况的金属混合物是( )
| A、Mg和Fe |
| B、Fe和Zn |
| C、Mg和Al |
| D、Al和Fe |
某溶液中可能存在Mg2+、Fe2+、Fe3+,加入NaOH 溶液,开始有白色絮状沉淀生成,白色沉淀迅速变成灰绿色,最后变成红褐色,下列结论正确的是( )
| A、一定有Fe2+,一定没有Mg2+、Fe3+ |
| B、一定有Fe3+,一定没有Mg2+、Fe2+ |
| C、一定有Fe3+,可能有Fe2+,一定没有Mg2+ |
| D、一定有Fe2+,可能有Mg2+,一定没有Fe3+ |