题目内容
两种金属混合粉末12克,与足量盐酸反应时生成标准状况下11.2L氢气,符合上述情况的金属混合物是( )
| A、Mg和Fe |
| B、Fe和Zn |
| C、Mg和Al |
| D、Al和Fe |
考点:有关混合物反应的计算
专题:计算题
分析:根据n=
计算出11.2L氢气的物质的量,假设金属都为+2价,然后根据摩尔质量的表达式M=
计算金属混合物的平衡摩尔质量,利用平均值法对各选项进行判断,注意金属铝转化成+2价时的摩尔质量为:
×2=18g/mol.
| V |
| Vm |
| m |
| n |
| 27g/mol |
| 3 |
解答:
解:11.2L氢气的物质的量为:n=
=0.5mol,假设金属都为+2价,则金属混合物的平均摩尔质量为:M=
=24g/mol,
A.Mg的相对分子质量为24,Fe的相对原子质量为56,二者的平均摩尔质量一定大于24g/mol,故A错误;
B.Zn的相对分子质量为65,Fe的相对原子量为56,二者的摩尔质量都大于24g/mol,12gZn和Fe的混合物与足量盐酸生成标况下氢气的体积一定小于11.2L,故B错误;
C.Mg的相对原子质量为24,当Al的化合价为+2价时,可看成其相对原子质量为:
×2=18g/mol,镁和铝的平均摩尔质量小于24g/mol,故C错误;
D.当Al的化合价为+2价时,可看成其摩尔质量为:
×2=18g/mol,Fe的相对原子量为56,二者的平均摩尔质量可以为24g/mol,故D正确;
故选D.
| 11.2L |
| 22.4L/mol |
| 12g |
| 0.5mol |
A.Mg的相对分子质量为24,Fe的相对原子质量为56,二者的平均摩尔质量一定大于24g/mol,故A错误;
B.Zn的相对分子质量为65,Fe的相对原子量为56,二者的摩尔质量都大于24g/mol,12gZn和Fe的混合物与足量盐酸生成标况下氢气的体积一定小于11.2L,故B错误;
C.Mg的相对原子质量为24,当Al的化合价为+2价时,可看成其相对原子质量为:
| 27g/mol |
| 3 |
D.当Al的化合价为+2价时,可看成其摩尔质量为:
| 27g/mol |
| 3 |
故选D.
点评:本题考查混合物的计算,题目难度中等,本题利用平均值法计算,注意化合价与相对原子质量的关系,明确平均摩尔质量法在计算金属混合物与酸反应中的应用.

练习册系列答案
相关题目
根据元素周期表,判断下列元素中不属于主族元素的是( )
| A、铁 | B、钙 | C、磷 | D、钠 |
依据元素周期表及元素周期律,下列推断正确的是( )
| A、P、S、Cl得电子能力和它们相应的最高价氧化物对应水化物的酸性均依次增强 |
| B、ⅠA族元素的金属性比ⅡA族元素的金属性强 |
| C、若M+和R2-的核外电子层结构相同,则原子序数R>M |
| D、Cl、Br、I的非金属性逐渐减弱,HCl、HBr、HI水溶液的酸性逐渐减弱 |
关于电解氯化钠溶液,下列叙述正确的是 ( )
| A、原电池的正极和电解池的阴极所发生的反应类型相同 |
| B、若在阳极附近的溶液中滴入KI淀粉试液,溶液呈蓝色 |
| C、若在阴极附近的溶液中滴入酚酞试液,溶液仍无色 |
| D、电解一段时间后,将全部电解液转移到烧杯中,加入适量盐酸充分搅拌后溶液可恢复原状况 |
下列物质中,属于酸性氧化物但不溶于水的是( )
| A、CO2 |
| B、SiO2 |
| C、SO2 |
| D、Fe2O3 |
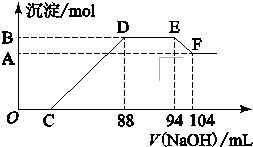 实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.现有一定量铝粉和铁粉的混合物与一定体积某浓度的稀硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入5mol?L-1的NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量关系如图所示.则
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.现有一定量铝粉和铁粉的混合物与一定体积某浓度的稀硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入5mol?L-1的NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量关系如图所示.则