题目内容
如图为自然界中氮循环的示意图.请回答:
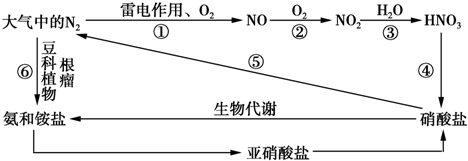
(1)上述转化中属于“氮的固定”的是 (填序号).
(2)铵盐是农业上常用的化肥.实验室常用加热氯化铵和氢氧化钙固体混合物的方法制取氨气,反应的化学方程式为 ,实验室可以用 试纸检验氨气.
(3)人类的某些活动也参与了自然界中氮的循环.上图③是工业制取硝酸的重要反应,其化学方程式为 ,该反应中氧化剂和还原剂的物质的量之比为 .若要尽可能多地使反应中的NO2被水吸收,可采取的措施为 .

(1)上述转化中属于“氮的固定”的是
(2)铵盐是农业上常用的化肥.实验室常用加热氯化铵和氢氧化钙固体混合物的方法制取氨气,反应的化学方程式为
(3)人类的某些活动也参与了自然界中氮的循环.上图③是工业制取硝酸的重要反应,其化学方程式为
考点:含氮物质的综合应用
专题:氮族元素
分析:(1)依据氮的固定是游离态氮元素变化为化合态分析;
(2)实验室制备氨气是利用氢氧化钙固体和氯化铵固体加热反应生成,氨气是碱性气体能使湿润的红色石蕊试纸变蓝;
(3)③反应是二氧化氮和水反应生成硝酸和一氧化氮,依据元素化合价变化计算氧化剂和还原剂物质的量之比,尽可能多地使反应中的NO2被水吸收需要通入氧气可以使二氧化氮全部被水吸收.
(2)实验室制备氨气是利用氢氧化钙固体和氯化铵固体加热反应生成,氨气是碱性气体能使湿润的红色石蕊试纸变蓝;
(3)③反应是二氧化氮和水反应生成硝酸和一氧化氮,依据元素化合价变化计算氧化剂和还原剂物质的量之比,尽可能多地使反应中的NO2被水吸收需要通入氧气可以使二氧化氮全部被水吸收.
解答:
解:(1)转化关系中大气中的氮气通过雷电作用生成一氧化氮,实现单质变化为化合物,属于氮的固定,大气中的氮气被豆科类植物根瘤菌吸收变化为铵盐或氨气,实现单质变化为化合物,属于氮的固定;
故答案为:①⑥;
(2)实验室制备氨气是利用氢氧化钙固体和氯化铵固体加热反应生成,反应水的化学方程式为:Ca(OH)2+2NH4Cl
CaCl2+2NH3↑+2H2O,氨气是碱性气体能使湿润的红色石蕊试纸变蓝,实验室中利用此性质检验氨气的存在;
故答案为:Ca(OH)2+2NH4Cl
CaCl2+2NH3↑+2H2O;湿润的红色石蕊试纸变蓝;
(3)③反应是二氧化氮和水反应生成硝酸和一氧化氮,反应的化学方程式为:3NO2+H2O=2HNO3+NO;
依据元素化合价变化计算,二氧化氮中氮元素化合价+4价变化为+5价做还原剂,变化为+2价做氧化剂,所以氧化剂和还原剂物质的量之比为1:2,尽可能多地使反应中的NO2被水吸收需要通入氧气可以使二氧化氮全部被水吸收,发生4NO2+O2+2H2O=4HNO3;
故答案为:3NO2+H2O=2HNO3+NO;1:2;在反应过程中不断通入氧气.
故答案为:①⑥;
(2)实验室制备氨气是利用氢氧化钙固体和氯化铵固体加热反应生成,反应水的化学方程式为:Ca(OH)2+2NH4Cl
| ||
故答案为:Ca(OH)2+2NH4Cl
| ||
(3)③反应是二氧化氮和水反应生成硝酸和一氧化氮,反应的化学方程式为:3NO2+H2O=2HNO3+NO;
依据元素化合价变化计算,二氧化氮中氮元素化合价+4价变化为+5价做还原剂,变化为+2价做氧化剂,所以氧化剂和还原剂物质的量之比为1:2,尽可能多地使反应中的NO2被水吸收需要通入氧气可以使二氧化氮全部被水吸收,发生4NO2+O2+2H2O=4HNO3;
故答案为:3NO2+H2O=2HNO3+NO;1:2;在反应过程中不断通入氧气.
点评:本题考查了含氮化合物转化关系分析和物质性质的理解应用,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
今有H2和CO(体积比为1:2)的混合气体V L,完全燃烧时,所需要同条件O2的体积为( )
| A、3V L |
| B、2V L |
| C、V L |
| D、0.5V L |
某有机物的蒸气,完全燃烧时,需3倍于其体积的氧气,产生2倍于其体积的CO2,该有机物是( )
| A、C2H4 |
| B、C3H6O |
| C、C2H4O |
| D、C2H4O2 |
关于电解氯化钠溶液,下列叙述正确的是 ( )
| A、原电池的正极和电解池的阴极所发生的反应类型相同 |
| B、若在阳极附近的溶液中滴入KI淀粉试液,溶液呈蓝色 |
| C、若在阴极附近的溶液中滴入酚酞试液,溶液仍无色 |
| D、电解一段时间后,将全部电解液转移到烧杯中,加入适量盐酸充分搅拌后溶液可恢复原状况 |
某种兴奋剂的结构简式如图,有关该物质的叙述中,正确的是( )


| A、遇氯化铁溶液显色 |
| B、能和NaHCO3反应产生CO2 |
| C、1 mol该物质分别能和4 mol溴、7 mol氢气完全反应 |
| D、滴入酸性高锰酸钾溶液,紫色褪去,证明结构中存在碳碳双键 |
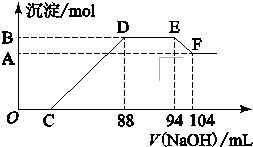 实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.现有一定量铝粉和铁粉的混合物与一定体积某浓度的稀硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入5mol?L-1的NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量关系如图所示.则
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.现有一定量铝粉和铁粉的混合物与一定体积某浓度的稀硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入5mol?L-1的NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量关系如图所示.则 )在一定条件下以等物质的量缩聚而成,则Nomex的结构简式为( )
)在一定条件下以等物质的量缩聚而成,则Nomex的结构简式为( )


