题目内容
关于微粒在指定溶液中能否大量共存的评价正确的是( )
| 选项 | 溶液 | 微粒 | 评价 |
| A | 8% H2O2水溶液 | Fe3+、Mg2+、SO42-、Na+ | 可以大量共存 |
| B | 室温下pH=12的水溶液 | NO3-、Na+、SO32-、K+ | NO3-能将SO32-氧化而不能大量共存 |
| C | 1 mol/L的NH4Cl溶液 | Ba2+、OH-、NH3?H2O、Na+ | NH4Cl溶液显酸性,NH3?H2O不能在其中大量共存 |
| D | NaHSO4水溶液 | I-、K+、CH3COO-、Br- | CH3COO-能与NaHSO4溶液反应,不能在其中大量共存 |
| A、A | B、B | C、C | D、D |
考点:离子共存问题
专题:离子反应专题
分析:A.铁离子能够促进双氧水的分解,在溶液中不能大量共存;
B.室温下pH=12的水溶液为碱性溶液,NO3-、Na+、SO32-、K+之间不反应,也不与氢氧根离子反应;
C.氢氧根离子与氯化铵溶液反应生成一水合氨;
D.硫酸氢钠在溶液中电离出氢离子,醋酸根离子与氢离子反应生成弱电解质醋酸
B.室温下pH=12的水溶液为碱性溶液,NO3-、Na+、SO32-、K+之间不反应,也不与氢氧根离子反应;
C.氢氧根离子与氯化铵溶液反应生成一水合氨;
D.硫酸氢钠在溶液中电离出氢离子,醋酸根离子与氢离子反应生成弱电解质醋酸
解答:
解:A.Fe3+为双氧水分解的催化剂,促进了双氧水的分解,在溶液中不可以大量共存,该评价不合理,故A错误;
B.室温下pH=12的水溶液中存在大量氢氧根离子,NO3-、Na+、SO32-、K+离子之间不发生反应,且都不与氢氧根离子反应,在溶液中可以大量共存,该评价错误,故B错误;
C.OH-与NH4Cl发生反应生成一水合氨,在溶液中不能大量共存,评价错误,故C错误;
D.NaHSO4水溶液中存在大量氢离子,CH3COO-能与NaHSO4溶液反应,在溶液中不能大量共存,该评价合理,故D正确;
故选D
B.室温下pH=12的水溶液中存在大量氢氧根离子,NO3-、Na+、SO32-、K+离子之间不发生反应,且都不与氢氧根离子反应,在溶液中可以大量共存,该评价错误,故B错误;
C.OH-与NH4Cl发生反应生成一水合氨,在溶液中不能大量共存,评价错误,故C错误;
D.NaHSO4水溶液中存在大量氢离子,CH3COO-能与NaHSO4溶液反应,在溶液中不能大量共存,该评价合理,故D正确;
故选D
点评:本题考查离子共存的正误判断,为中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间; 能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;解决离子共存问题时还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色;选项A为易错点,注意铁离子能够促进双氧水的分解.

练习册系列答案
相关题目
下列有关各装置图及对应实验的描述正确的是( )
A、 电解精炼铝 |
B、 制备Fe(OH)2 |
C、 制得金属铁 |
D、 验证NaHC03和Na2C03的热稳定性 |
下列说法正确的是( )
| A、氯水就是液氯 |
| B、铜丝在氯气燃烧,生成蓝色固体 |
| C、氯气在氢气中燃烧产生苍白色火焰 |
| D、钠在氯气中燃烧生成白色固体氯化钠 |
下列物质是第三周期元素最高价氧化物对应的水化物(含氧酸),其中酸性就强的是( )
| A、H2SiO3 |
| B、H3PO4 |
| C、H2SO4 |
| D、HClO4 |
根据元素周期表,判断下列元素中不属于主族元素的是( )
| A、铁 | B、钙 | C、磷 | D、钠 |
今有H2和CO(体积比为1:2)的混合气体V L,完全燃烧时,所需要同条件O2的体积为( )
| A、3V L |
| B、2V L |
| C、V L |
| D、0.5V L |
 如图,p,q为直流电源两极,A为+2价金属单质X制成,B,C,D为铂电极,接通电源,金属X沉淀与B极,同时C,D产生气泡,试回答:
如图,p,q为直流电源两极,A为+2价金属单质X制成,B,C,D为铂电极,接通电源,金属X沉淀与B极,同时C,D产生气泡,试回答: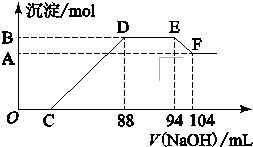 实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.现有一定量铝粉和铁粉的混合物与一定体积某浓度的稀硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入5mol?L-1的NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量关系如图所示.则
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.现有一定量铝粉和铁粉的混合物与一定体积某浓度的稀硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入5mol?L-1的NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量关系如图所示.则