题目内容
11.R、W、X、Y、Z 为原子序数依次递增的同一短周期元素,下列说法一定正确的是(m,n 均为整数)( )| A. | 若R(OH)n为强碱,则W(OH)m也为强碱 | |
| B. | 若HnXOm为强酸,则Y是活泼非金属元素 | |
| C. | 若Y 的最低负化合价为一2,则Z的最高正化合价为+7 | |
| D. | 若X 的最高正化合价为十5,则五种元素一定都是非金属元素 |
分析 A.元素的金属性越强,其最高价氧化物的水化物碱性越强;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强,但O、F元素除外;
C.Y的最低负化合价为-2价,Y位于第VIA族,Z位于第VIIA族,可能没有正化合价;
D.若X的最高正化合价为+5,R可能是金属元素,也可能是非金属元素.
解答 解:A.同一周期的元素,原子序数越大,元素的金属性越弱,其相应的碱的碱性越弱,所以若R(OH)n为强碱,W(OH)m不一定为强碱,如NaOH是强碱、氢氧化镁是弱碱,故A错误;
B.同一周期的元素,原子序数越大,元素的非金属性越强,最高价含氧酸的酸性就越强,所以若HnXOm为强酸,X是比较活泼的非金属元素,则Y的非金属性比X强,也是活泼非金属元素,故B正确;
C.若Y 的最低负化合价为一2,Y是第 VIA的元素,则Z是第七主族的元素,Z可能是F,由于F是非金属性最强的元素,不可能失去电子或形成共用电子对偏离F元素,则Z就没有最高正化合价+7,故C错误;
D.若X 的最高正化合价为十5,则X是第 VA族的元素,则这五种元素可能都是非金属元素,也可能既有金属也有非金属元素,故D错误;
故选B.
点评 本题考查原子结构和元素周期律,为高频考点,侧重考查学生分析判断及对元素周期律的灵活运用,明确同一周期元素原子结构、元素性质递变规律是解本题关键,注意规律中的反常现象,易错选项是C.

练习册系列答案
相关题目
2.环癸五烯的结构简式可表示为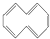 ,下列说法正确的是( )
,下列说法正确的是( )
 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 根据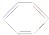 的结构特点可知环癸五烯的分子式为C10H8 的结构特点可知环癸五烯的分子式为C10H8 | |
| B. | 常温常压下环癸五烯是一种易溶于水的无色气体 | |
| C. | 环癸五烯既能使溴水褪色,又能使酸性KMnO4溶液褪色 | |
| D. | 环癸五烯与Cl2的加成产物只有一种 |
19.下列指定反应的离子方程式正确的是( )
| A. | 次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO | |
| B. | NaHCO3溶液中加入足量的Ba(OH)2溶液:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| C. | 钠和水反应:Na+H2O═Na++OH-+H2↑ | |
| D. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- |
6.下列反应过程中的能量变化与如图一致的是( )
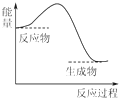

| A. | 2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 | B. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | ||
| C. | C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2 | D. | C+CO2$\frac{\underline{\;\;△\;\;}}{\;}$2CO |
3.下列分子中的中心原子杂化轨道的类型相同的是( )
| A. | CH4与C2H4 | B. | BF3与NH3 | C. | BeCl2与SCl2 | D. | H2O与H2S |
20.下列说法正确的是( )
| A. | 非金属单质中一定存在共价键 | |
| B. | 含共价键的化合物一定是共价化合物 | |
| C. | 含离子键的化合物一定是离子化合物 | |
| D. | 溶于水能导电的化合物就是离子化合物 |
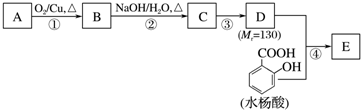
 .
.