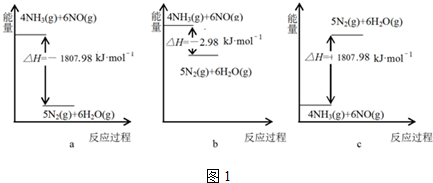
题目内容
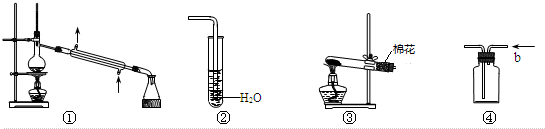
4.铝是一种重要的金属,在生产、生活中具有许多重要的用途,如图是从铝土矿中制备铝的工艺流程:
(已知铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质)回答下列问题:
(1)写出铝元素在周期表中的位置第三周期ⅢA族,已知Fe的原子序数为26,原子最外层只有2个电子,则Fe的原子结构示意图为
 .
.(2)在流程第三步“酸化”中,加入的最佳物质B是CO2或二氧化碳,反应的离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
(3)工业上不用电解熔融AlCl3制取金属铝的原因是AlCl3是共价化合物,熔融状态下不导电.
(4)SiO2可用于工业制粗硅,反应的化学方程式为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
(5)现有a g铝热剂,含Al和Fe2O3,且高温条件下两者可恰好完全反应.如果将其投入足量的NaOH溶液中充分反应,在标准状况下可搜集到的气体的体积为$\frac{67.2a}{214}$L.(用含a的式子表示)
分析 铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质,加入足量的氢氧化钠,氧化铝、二氧化硅与NaOH溶液反应均生成盐和水,只有氧化铁与碱不反应,结合信息②可知还生成Na2Al2Si2O8沉淀,过滤后得滤渣Fe2O3、Na2Al2Si2O8;滤液用二氧化碳酸化时,将NaAlO2完全转化为Al(OH)3,反应的离子方程式为:AlO2-+2H2O+CO2═HCO3-+Al(OH)3↓;过滤得氢氧化铝沉淀,灼烧得氧化铝,电解氧化铝得单质铝,以此解答该题.
解答 解:铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质,加入足量的氢氧化钠,氧化铝、二氧化硅与NaOH溶液反应均生成盐和水,只有氧化铁与碱不反应,结合信息②可知还生成Na2Al2Si2O8沉淀,过滤后得滤渣Fe2O3、Na2Al2Si2O8;滤液用二氧化碳酸化时,将NaAlO2完全转化为Al(OH)3,反应的离子方程式为:AlO2-+2H2O+CO2═HCO3-+Al(OH)3↓;过滤得氢氧化铝沉淀,灼烧得氧化铝,电解氧化铝得单质铝.
(1)Al的原子序数为13,原子核外有3个电子层,最外层电子数为3,位于周期表第三周期ⅢA 族,已知Fe的原子序数为26,原子最外层只有2个电子,则Fe的原子结构示意图为 ,
,
故答案为:第三周期ⅢA 族; ;
;
(2)在流程第三步“酸化”的目的是生成氢氧化铝沉淀,应通入二氧化碳,反应的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为:CO2或二氧化碳;AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(3)因AlCl3是共价化合物,熔融状态下不导电,工业用电解熔融的氧化铝制备铝,故答案为:AlCl3是共价化合物,熔融状态下不导电;
(4)SiO2可用于工业制粗硅,反应的化学方程式为SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,故答案为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;
(5)反应方程式为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,a g铝热剂中含有xmolAl,则27x+0.5x×160=a,x=$\frac{a}{107}$mol,与氢氧化钠反应发生2Al+2NaOH+2H2O=2NaAlO2+3H2↑,可知生成n(H2)=$\frac{3a}{214}$mol,体积为$\frac{67.2a}{214}$L,
故答案为:$\frac{67.2a}{214}$L.
点评 本题考查Al及其化合物的化学性质、物质分离提纯方法和基本操作的综合应用,注意把握流程中发生的化学反应为解答的关键,注重信息与所学知识的结合分析解决问题,侧重知识迁移应用能力的考查,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | A、B、C、D能形成5种以上单质 | |
| B. | D能分别与A、B、C反应越来越难 | |
| C. | X、Y、Z的稳定性逐渐增强 | |
| D. | B的气态氢化物能与其最高价含氧酸反应 |
| A. | OH-+2CO32-+3H+→2HCO3-+H2O | B. | 2OH-+CO32-+3H+→HCO3-+2H2O | ||
| C. | 2OH-+CO32-+4H+→CO2↑+3H2O | D. | OH-+CO32-+3H+→CO2↑+2H2O |
| A. | 装置①可用于除去乙醇中微量的食盐 | |
| B. | 装置②可用于检验CO2气体 | |
| C. | 以KMnO4为原料,装置③可用于实验室制备少量O2的发生装置 | |
| D. | 装置④b口进气可收集H2、N2等气体 |
| A. | 聚乙烯食品包装袋、食物保鲜膜都是无毒的高分子化合物 | |
| B. | 高纯度的二氧化硅广泛用于制作光导纤维,遇强碱会“断路” | |
| C. | 煤经过气化和液化两种物理变化,可变为清洁能源 | |
| D. | 加热能杀死甲型H1N1流感病毒,主要是加热后使病毒中的蛋白质变性 |
| A. | CuSO4 | B. | NaNO3 | C. | KCl | D. | H2SO4 |