题目内容
9.下列热化学方程式中的△H能表示物质燃烧热的是( )| A. | C(s)+$\frac{1}{2}$O2(g)═CO(g)△H1=-110.35kJ•mol-1 | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890kJ•mol-1 | |
| C. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1 | |
| D. | H2(g)+Cl2(g)═2HCl(g)△H=-184.6kJ•mol-1 |
分析 燃烧热表示1mol可燃物完全燃烧生成稳定氧化物所放出的热量,表示燃烧热的热化学方程式中可燃物为1mol,产物为稳定氧化物.
解答 解:A.C的稳定氧化物为二氧化碳,所以△H不代表燃烧热,故A错误;
B、CH4的化学计量数为1,产物为稳定氧化物,符合燃烧热的定义,所以△H代表燃烧热,故B正确;
C.氢气的计量系数为2,所以△H不代表燃烧热,故C错误;
D.燃烧热表示1mol可燃物完全燃烧生成稳定氧化物放出的热量,HCl不是氧化物,故不符合燃烧热的定义,故D错误;
故选:B.
点评 本题考查了燃烧热的概念,题目难度不大,理解此概念是应注意:可燃物的物质的量必须是1mol;生成的产物必须是稳定氧化物,例如碳形成二氧化碳、氢形成液态水.

练习册系列答案
相关题目
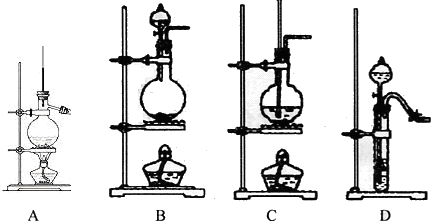
10.实验是化学研究的基础,下列有关各实验装置图的叙述中,不正确的是( )


| A. | 装置①可用于除去乙醇中微量的食盐 | |
| B. | 装置②可用于检验CO2气体 | |
| C. | 以KMnO4为原料,装置③可用于实验室制备少量O2的发生装置 | |
| D. | 装置④b口进气可收集H2、N2等气体 |
20.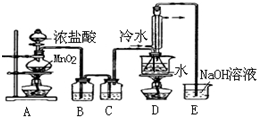 S2Cl2是工业上常用的硫化剂,实验室制备S2Cl2的方法有2种:
S2Cl2是工业上常用的硫化剂,实验室制备S2Cl2的方法有2种:
①CS2+3Cl2$\stackrel{50-60℃}{→}$CCl4+S2Cl2;
②2S+Cl2$\stackrel{90-100℃}{→}$S2Cl2.
已知S2Cl2中硫元素显+1价,S2Cl2不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低).
反应涉及的几种物质的熔沸点如表:
实验室利用下列装置通过方法①来制备S2Cl2(部分夹持仪器已略去).回答下列问题:
(1)S2Cl2分子中各原子都满足最外层8电子结构,则其电子式为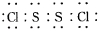 .
.
(2)实验中盐酸通常采用36.5%的浓溶液,不用稀盐酸的理由是稀盐酸还原性弱,反应困难.
(3)D中采用热水浴加热的原因是使CS2平稳汽化,避免产物S2Cl2汽化.
(4)D中冷凝管起到导气和冷凝回流双重作用.这种冷却装置可应用于下列高中化学中BC实验.
A.银镜反应 B.制取乙酸乙酯 C.制取溴苯 D.制备乙烯
(5)A装置仪器装配时,整套装置装配完毕后,应先进行气密性检查,再添加试剂.实验完毕,拆除装置时,应先将E中长导管移开液面,目的是防止倒吸.
(6)实验过程中,若缺少C装置,则发现产品浑蚀不清且生成两种有刺激性气味的气体,出现该现象的原因可用化学方程式表示为2S2Cl2+2H2O=3S↓+SO2↑+4HCl↑.实验完毕,当把剩余浓盐酸倒入E烧杯中与吸收了尾气的浓氢氧化钠溶液混合时,发现有少量黄绿色刺激性气体产生,产生该现象的原因是ClO-+2H++Cl-=Cl2↑+H2O.(用离子方程式表示)
 S2Cl2是工业上常用的硫化剂,实验室制备S2Cl2的方法有2种:
S2Cl2是工业上常用的硫化剂,实验室制备S2Cl2的方法有2种:①CS2+3Cl2$\stackrel{50-60℃}{→}$CCl4+S2Cl2;
②2S+Cl2$\stackrel{90-100℃}{→}$S2Cl2.
已知S2Cl2中硫元素显+1价,S2Cl2不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低).
反应涉及的几种物质的熔沸点如表:
实验室利用下列装置通过方法①来制备S2Cl2(部分夹持仪器已略去).回答下列问题:
| 物质 | S | CS2 | CCl4 | S2Cl2 |
| 沸点/℃ | 445 | 47 | 77 | 137 |
| 熔点/℃ | 113 | -109 | -23 | -77 |
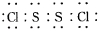 .
.(2)实验中盐酸通常采用36.5%的浓溶液,不用稀盐酸的理由是稀盐酸还原性弱,反应困难.
(3)D中采用热水浴加热的原因是使CS2平稳汽化,避免产物S2Cl2汽化.
(4)D中冷凝管起到导气和冷凝回流双重作用.这种冷却装置可应用于下列高中化学中BC实验.
A.银镜反应 B.制取乙酸乙酯 C.制取溴苯 D.制备乙烯
(5)A装置仪器装配时,整套装置装配完毕后,应先进行气密性检查,再添加试剂.实验完毕,拆除装置时,应先将E中长导管移开液面,目的是防止倒吸.
(6)实验过程中,若缺少C装置,则发现产品浑蚀不清且生成两种有刺激性气味的气体,出现该现象的原因可用化学方程式表示为2S2Cl2+2H2O=3S↓+SO2↑+4HCl↑.实验完毕,当把剩余浓盐酸倒入E烧杯中与吸收了尾气的浓氢氧化钠溶液混合时,发现有少量黄绿色刺激性气体产生,产生该现象的原因是ClO-+2H++Cl-=Cl2↑+H2O.(用离子方程式表示)
17.短周期元素甲、乙、丙、丁的原子序数依次增大,甲的L层电子数是K层的3倍,丁所在族 序数是周期数的2倍,乙、丙、丁的最外层电子数之和为10.下列说法正确的是( )
| A. | 简单离子半径:乙>丙>丁 | |
| B. | 最高价氧化物对应的水化物的碱性:乙>丙 | |
| C. | 简单气态氢化物稳定性:丁>甲 | |
| D. | 甲和丁组成的化合物在熔融状态下可以导电 |
14.用惰性电极电解下列溶液,电解一段时间后,阴极质量增加,电解液pH下降的是( )
| A. | CuSO4 | B. | NaNO3 | C. | KCl | D. | H2SO4 |
1.一定量的锌粉和2mol•L-1的过量盐酸反应,当向其中加入少量的下列物质时,能够加快反应速率,又不影响产生H2总量的是( )
①石墨 ②CuO ③铜粉 ④铁粉 ⑤浓盐酸 ⑥醋酸钠固体.
①石墨 ②CuO ③铜粉 ④铁粉 ⑤浓盐酸 ⑥醋酸钠固体.
| A. | ①③④ | B. | ①③⑤ | C. | ②④⑥ | D. | ②⑤⑥ |
18.合成具有美白作用的化妆品原料Z的反应原理如下:下列叙述不正确的是( )


| A. | 该反应的反应类型为加成反应 | |
| B. | X、Z均能与Na2CO3溶液反应 | |
| C. | X、Y、Z均能使溴水褪色,且原理相同 | |
| D. | X可作缩聚反应单体,Y可作加聚反应单体 |
19.下列有关性质的比较,不能用元素周期律解释的是( )
| A. | 密度:Na>K | B. | 稳定性:HCl>HBr | C. | 还原性:I?>Br? | D. | 碱性:KOH>NaOH |