题目内容
1.下列措施或事实不能用勒沙特列原理解释的是( )| A. | H2、I2(g)、HI平衡混合气体加压后颜色变深(已知:H2+I2?2HI) | |
| B. | 棕红色的NO2加压后颜色先变深后变浅(已知:2NO2 (g)?N2O4 (g)) | |
| C. | 工业上生产硫酸的过程中,使用过量的空气以提高SO2的利用率 | |
| D. | 滴加酚酞的氨水中加入氯化铵固体后红色变浅 |
分析 勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动,使用勒夏特列原理时,该反应必须是可逆反应且存在平衡过程,否则勒夏特列原理不适用.
A.可逆反应为H2(g)+I2(g)?2HI(g),反应前后气体的体积不发生变化,增大压强平衡不移动;
B.加压先是体积缩小,颜色变深,后平衡正向移动,颜色变浅;
C.通入空气会增大氧气浓度,平衡正向进行,二氧化硫转化率增大;
D.氨水中存在NH3•H2O?NH4++OH-,加入氯化铵增加了铵根离子的浓度,平衡逆向移动.
解答 解:A.可逆反应为H2(g)+I2(g)?2HI(g),增大压强I2的浓度增大,颜色加深,反应前后气体的体积不发生变化,增大压强平衡不移动,不能用勒夏特列原理解释,故A选;
B.棕红色NO2加压后颜色先变深后变浅,加压先是体积缩小,颜色变深,后平衡正向移动,颜色变浅,能用勒夏特列原理解释,故B不选;
C.SO2催化氧化成SO3的反应,往往加入过量的空气,增加反应物的浓度平衡正向移动,能用勒夏特列原理解释,故C不选;
D.氨水中存在NH3•H2O?NH4++OH-,加入氯化铵增加了铵根离子的浓度,平衡逆向移动,氢氧根浓度变小,红色变浅,能用勒夏特列原理解释,故D不选;
故选A.
点评 本题考查了勒夏特利原理、平衡移动等,题目难度中等,注意改变压强的实质是改变体积,影响反应混合物的浓度.

练习册系列答案
相关题目
5.下表是25℃时三种弱酸的电离平衡常数:
回答下列问题:
(1)用离子方程式表示NaNO2溶液呈碱性的原因NO2-+H2O?HNO2+OH-.
(2)NaHCO3的电离方程式是NaHCO3=Na++HCO3-.
(3)A-、CO32-、HCO3-在水中结合H+的能力由大到小的顺序为CO32->A->HCO3->NO2-.
(4)25℃时,等物质的量浓度的HA和NaA的混合溶液呈碱性,则该混合溶液中各离子浓度大小关系为c(Na+)>c(A-)>c(OH-)>c(H+),解释HA和NaA的混合溶液呈碱性的原因A-离子水解程度大于HA电离程度.
(5)写出NaA溶液中通少量CO2的离子方程式A-+CO2+H2O=HA+HCO3-.
(6)某同学用Na2CO3和NaHCO3溶液进行如图所示实验.
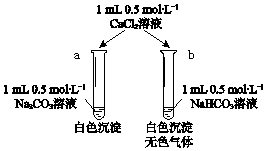
①充分反应后a试管中大量存在的离子是Na+、Cl-.
②用离子方程式表示b试管中发生的反应2HCO3-+Ca2+=CaCO3↓+CO2↑+H2O.
| 化学式 | HA(A代表某种酸根) | HNO2 | H2CO3 |
| Ka | Ka=4.9×10-10 | Ka=4.6×10-4 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
(1)用离子方程式表示NaNO2溶液呈碱性的原因NO2-+H2O?HNO2+OH-.
(2)NaHCO3的电离方程式是NaHCO3=Na++HCO3-.
(3)A-、CO32-、HCO3-在水中结合H+的能力由大到小的顺序为CO32->A->HCO3->NO2-.
(4)25℃时,等物质的量浓度的HA和NaA的混合溶液呈碱性,则该混合溶液中各离子浓度大小关系为c(Na+)>c(A-)>c(OH-)>c(H+),解释HA和NaA的混合溶液呈碱性的原因A-离子水解程度大于HA电离程度.
(5)写出NaA溶液中通少量CO2的离子方程式A-+CO2+H2O=HA+HCO3-.
(6)某同学用Na2CO3和NaHCO3溶液进行如图所示实验.

①充分反应后a试管中大量存在的离子是Na+、Cl-.
②用离子方程式表示b试管中发生的反应2HCO3-+Ca2+=CaCO3↓+CO2↑+H2O.
8.设阿伏加德罗常数为NA,下列说法中正确的是(Mg-24 H-1 O-16)( )
| A. | 18g H2O含有的电子数8NA | |
| B. | 常温常压下,1L0.2mol/L MgCl2溶液中含Cl-数为0.2NA | |
| C. | 常温常压下,22.4L的氧气中含氧原子数为2NA | |
| D. | 2.4g的Mg粉与足量的盐酸反应失去电子数为0.2NA |
12.我国许多城乡居民已经推广使用清洁燃料,如天然气和液化石油气(LPG).关于这两类燃料的说法错误的是( )
| A. | 都是混合物 | |
| B. | 前者主要含甲烷,后者主要含丙烷、丁烷 | |
| C. | 主要成分都是烷烃 | |
| D. | 常温常压下,前者呈气态,后者呈液态 |
6.用NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 2.24 L CH4中含碳原子数目是0.1 NA | |
| B. | 0.1 mol•L-1 NaNO3溶液中含Na+数目是0.1 NA | |
| C. | 1 mol Cl2与足量的铁完全反应时得到的电子数目是2 NA | |
| D. | 标准状况下,22.4 L苯中含分子数目是NA |
13.下列实验不能达到预期目的是( )
| A. |  探究乙烯与Br2的加成反应 | B. |  探究苯分子是否含有碳碳双键 | ||
| C. |  探究乙醇的还原性 | D. |  制取少量乙酸乙酯 |
10.下列有关金属腐蚀与防护的说法正确的是( )
| A. | 铁上镀锌的保护方法叫牺牲负极的正极保护法 | |
| B. | 相同条件下,轮船在海水中比在淡水中腐蚀慢 | |
| C. | 钢铁在潮湿的空气中会发生吸氧腐蚀,负极反应为Fe-3e-=Fe3+ | |
| D. | 水库里钢闸门与电源负极相连的方法叫做外加电流的阴极保护法 |
11.常温下,PH=12的Ba(OH)2 溶液,下列说法不正确( )
| A. | 此溶液中由水电离C(OH-)=1×10-12mol/L | |
| B. | 加入等体积PH=2 CH3COOH溶液后溶液呈中性 | |
| C. | 此溶液中C(OH-)=1×10-2mol/L | |
| D. | 加水稀释100后,溶液的PH=10 |
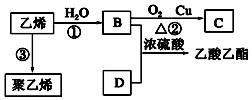 已知乙烯能发生以下转化:
已知乙烯能发生以下转化: ,列举聚乙烯的一种用途制塑料.
,列举聚乙烯的一种用途制塑料.