题目内容
7.下列表述中正确的是( )| A. | 已知2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ | |
| B. | 由C(石墨,s)═C(金刚石,s)△H=+11.9 kJ•mol-1可知,金刚石比石墨稳定 | |
| C. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件的△H不同 | |
| D. | 任何一个化学变化都伴随着能量的变化 |
分析 A.燃烧热的定义是1 mol可燃物完全燃烧生成稳定氧化物的热效应,单位是kJ•mol-1;
B.根据石墨到金刚石吸热知,石墨的能量低,能量越低越稳定;
C.△H与反应条件无关;
D.反应实质是断裂化学键吸收能量和形成化学键放出的热量,反应过程中一定伴随能量的变化.
解答 解:A.燃烧热的定义是1 mol可燃物完全燃烧生成稳定氧化物的热效应,产物水应为液态且燃烧热的单位是kJ•mol-1,故A错误;
B.根据石墨到金刚石吸热知,石墨的能量低,能量越低越稳定,石墨比金刚石稳定,故B错误;
C.△H=生成物总焓-反应物总焓,知△H与反应条件无关,故C错误;
D.任何一个化学反应生成物总焓不等于反应物总焓,总有能量变化,故D正确;
故选D.
点评 本题考查了化学反应能量变化、反应焓变意义和计算,注意物质能量越高越活泼,题目较简单.

练习册系列答案
相关题目
17.如表中评价合理的是( )
| 选项 | 化学反应及其离子方程式 | 评价 |
| A | FeO与足量的稀硝酸反应: FeO+2H+═Fe2++H2O | 正确 |
| B | 向硫酸铵溶液中加入氢氧化钡溶液: Ba2++SO42-═BaSO4↓ | 正确 |
| C | 碳酸氢钠溶液中滴加少量的石灰水: 2HCO3-+Ca2++2OH-═CO32-+CaCO3↓+2H2O | 错误,HCO3-、OH-和H2O的系数应均为1,生成物中没有CO32- |
| D | 用食醋除去水瓶中的水垢: CaCO3+2H+═Ca2++H2O+CO2↑ | 错误,醋酸是弱酸,不应写成H+形式 |
| A. | A | B. | B | C. | C | D. | D |
2.下列说法正确的是( )
| A. | 已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(l);△H=-285.8 kJ•mol-1,则H2的燃烧热为-285.8 kJ•mol-1 | |
| B. | 已知:S(g)+O2(g)═SO2(g)△H1=-Q1;S(s)+O2(g)═SO2(g)△H2=-Q2,则Q1<Q2 | |
| C. | 已知:$\frac{1}{2}$H2SO4(浓)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H1; CH3COOH(aq)+NH3•H2O(aq)═CH3COONH4(aq)+H2O(l)△H2,则有|△H1|<|△H2| | |
| D. | 已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g)△H=+489.0 kJ•mol-1 CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0 kJ•mol-1 C(石墨)+O2(g)═CO2(g)△H=-393.5 kJ•mol-1 则4Fe(s)+3O2(g)═2Fe2O3(s)△H=-1641.0 kJ•mol-1 |
12.下列反应的离子方程式正确的是( )
| A. | 用惰性电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| B. | 向NaClO溶液中滴加少量FeSO4溶液:5ClO-+2Fe2++5H2O═4HClO+Cl-+2Fe(OH)3↓ | |
| C. | 向NH4HCO3稀溶液中滴加过量Ca(OH)2溶液:NH4++HCO3-+2OH-═NH3•H2O+CO32-+H2O | |
| D. | 向CuSO4溶液中滴加过量氨水:Cu2++2 NH3•H2O═Cu(OH)2↓+2 NH4+ |
19.某校化学实验兴趣小组在“探究卤索单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入l~2滴溴水,振荡后溶液呈黄色.
提出问题:Fe3+、Br2谁的氧化性更强?
(1)猜想:
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含Br2(填化学式,下同)所致.
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含Fe3+所致.
(2)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的.
供选用的试剂:a.酚酞试液;b.CCl4;c.无水酒精;d.KSCN溶液.
请你在表中写出丙同学选用的试剂及实验中观察到的现象.(试剂填序号)
(3)结论:氧化性:Br2>Fe3+.故在足量的稀氯化亚铁溶液中,加入l~2滴溴水,溶液呈黄色所发生的离子反应方程式为Br2+2Fe2+=2Fe3++2Br-.
(4)实验后的思考
①根据上述实验推测,若在溴化亚铁溶液中通入氯气,首先被氧化的离子是:Fe2+(填离子的化学式).
②在100mL FeBr2溶液中通入2.24L Cl2(标准状况),溶液中有1/2的Br-被氧气成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为1mol•L-1.
提出问题:Fe3+、Br2谁的氧化性更强?
(1)猜想:
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含Br2(填化学式,下同)所致.
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含Fe3+所致.
(2)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的.
供选用的试剂:a.酚酞试液;b.CCl4;c.无水酒精;d.KSCN溶液.
请你在表中写出丙同学选用的试剂及实验中观察到的现象.(试剂填序号)
| 选用试剂 | 实验现象 | |
| 方案1 | ||
| 方案2 |
(4)实验后的思考
①根据上述实验推测,若在溴化亚铁溶液中通入氯气,首先被氧化的离子是:Fe2+(填离子的化学式).
②在100mL FeBr2溶液中通入2.24L Cl2(标准状况),溶液中有1/2的Br-被氧气成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为1mol•L-1.
16.下列给定条件的有机化合物的同分异构体数目正确的是
| 选项 | 给定条件的有机化合物 | 同分异构体数目 |
| A | 分子式为C4H9Cl的有机物 | 3种 |
| B | 分子式为C5H10O2的一元酯 | 8种 |
| C | 分子式为C5H10的环烷烃 | 3种 |
| D | 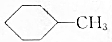 的一溴代物 的一溴代物 | 5种 |
| A. | A | B. | B | C. | C | D. | D |
17.工业上食用油的生产大多数采用浸出工艺.菜籽油的生产过程为将菜籽压成薄片,用轻汽油浸泡,进行操作A:过滤,得液体混合物;对该混合物迸行操作B,制成半成品油,再经过脱胶、脱色、脱臭即制成食用油.操作A和B的名称分别是( )
| A. | 溶解、蒸发 | B. | 萃取、蒸馏 | C. | 分液、蒸馏 | D. | 萃取、过滤 |

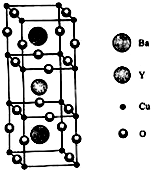 铜族元素包括Cu、Ag、Au,其单质均为面心立方晶体.
铜族元素包括Cu、Ag、Au,其单质均为面心立方晶体.