题目内容
7.铁、铝、铜等金属及其化合物在日常生活中应用广泛,请回答下列问题:(1)单质铁属于金属晶体.黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料,其中一个反应为3FeS2+8O2$\frac{\underline{\;高温\;}}{\;}$6SO2+Fe3O4,氧化产物为SO2和Fe3O4,若有3molFeS2参加反应,转移32mol电子.
(2)铝的价电子排布式为3s23p1,明矾用作净水剂,其原理为Al3++3H2O=Al(OH)3(胶体)+3H+(用离子方程式表示).
(3)金属Cu单独与氨水或单独与双氧水都不反应,但可与二者的混合溶液反应生成深蓝色溶液,Cu与氨水、双氧水反应的离子方程式Cu+4NH3•H2O+H2O2=[Cu(NH3)4]2++4H2O+2OH-;
(4)铁红是一种红色颜料,其成分是Fe2O3,将一定量的铁红溶于160mL5mol•L-1盐酸中,再加入一定量铁粉恰好溶解,收集到2.24L氢气(标准状况),经检测溶液中无Fe3+,参加反应的铁粉的质量为11.2g.
分析 (1)金属单质属于金属晶体;化合价升高后的产物为氧化产物,反应3FeS2+8O2=Fe3O4+6SO2中Fe元素化合价又+2→+3,化合价升高,S元素化合价由-1→+4,化合价升高,O元素化合价由0→-2,化合价降低;
(2)Al是13号元素,其价电子是最外层电子,根据构造原理书写其基态原子价电子排布式;明矾净水原理是电离出的铝离子水解生成氢氧化铝胶体具有吸附性;
(3)金属Cu单独与氨水或单独与双氧水都不反应,但可与二者的混合溶液反应生成深蓝色溶液,说明反应生成[Cu(NH3)4]2+;
(4)铁先与Fe3+反应,然后再与氢离子反应,结合反应的离子方程式计算.
解答 解:(1)单质铁属于金属单质,为金属晶体,反应3FeS2+8O2=Fe3O4+6SO2,前后各元素化合价的变化情况如下:Fe:+2→+3,化合价升高;S:-1→+4,化合价升高;O:0→-2,化合价降低;因此,在反应中FeS2还原剂,O2是氧化剂,Fe3O4既是氧化产物也是还原产物,SO2既是氧化产物也是还原产物;在上述反应中共转移32个电子,有3molFeS2参加反应,转移电子的物质的量为32mol,
故答案为:金属;SO2和Fe3O4; 32;
(2)Al是13号元素,根据构造原理知其基态原子电子排布式为1s22s22p63s23p1,其价电子是最外层电子,所以价电子排布式为3s23p1,明矾在溶液中完全电离出钾离子、铝离子和硫酸根离子,电离方程式为:KAl(SO4)2=K++Al3++2SO42-,明矾净水原理是硫酸铝钾溶液中含有铝离子,铝离子水解Al3++3H2O=Al(OH)3(胶体)+3H+,
故答案为:3s23p1;Al3++3H2O=Al(OH)3(胶体)+3H+;
(3)金属Cu单独与氨水或单独与双氧水都不反应,但可与二者的混合溶液反应生成深蓝色溶液,说明反应生成[Cu(NH3)4]2+,反应离子方程式为:Cu+4NH3•H2O+H2O2=[Cu(NH3)4]2++4H2O+2OH-,
故答案为:Cu+4NH3•H2O+H2O2=[Cu(NH3)4]2++4H2O+2OH-;
(4)氢气的物质的量为 0.1mol,
由关系式Fe~~~~2HCl~~~H2,得到
0.1mol 0.2mol 0.1mol
根据氯原子守恒,所以氯化铁的物质的量为$\frac{1}{3}$×(0.16L×5mol/L-0.2mol)=0.2mol,
Fe~~~2FeCl3
0.1mol 0.2mol
所以参加反应的铁粉的质量为(0.1mol+0.1mol)×56g/mol=11.2g,
故答案为:11.2g.
点评 本题综合考查元素化合物知识,为高频考点,侧重学生的分析、计算能力的考查,注意把握铁、铝、铜等金属及其化合物的性质,题目难度中等.

 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案| A. | 体积都是22.4 L | B. | 具有相同的体积 | ||
| C. | 都是双原子分子 | D. | 具有相同的分子数目 |
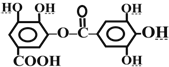
| A. | 该有机物的分子式为C14H10O9 | |
| B. | 常温下,与Na2CO3溶液反应放出CO2 | |
| C. | 与稀H2SO4共热,生成两种有机物 | |
| D. | 能发生碱性水解,1mol该有机物完全反应消耗8molNaOH |
| A. | 对于反应CH2=CH2(g)+H2(g)→CH3CH3(g)△H<0,若使用催化剂,反应过程中放出的热量更多 | |
| B. | CO燃烧的热化学方程式为2CO(g)+O2(g)=2CO2(g)△H=+285.8kJ/mol | |
| C. | 反应2Mg+CO2=2MgO+C△H<0从熵变角度看,不可自发进行 | |
| D. | 在密闭容器中,2HI(g)?H2(g)+I2(g)△H=+14.9kJ/mol,若投入NA个HI分子,反应平衡时,吸热7.45kJ |
| A. | Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s)△H=-216 kJ•mol-1,反应物总能量<生成物总能量 | |
| B. | 已知2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ•mol-1,H2的燃烧热为241.8 kJ•mol-1 | |
| C. | 相同条件下,1 mol氢原子所具有的能量为E1,1 mol 氢分子的能量为E2,则2E1>E2 | |
| D. | H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,含1 mol NaOH的NaOH溶液与含0.5 mol H2SO4的浓硫酸混合后放出57.3 kJ 的热量 |
| A. | NA个Fe(OH)3胶体粒子的质量为107 g | |
| B. | 8.0 g Cu2S和CuO的混合物中含有铜原子数为0.1NA | |
| C. | 标准状况下,2.24 L Cl2溶于水中达到饱和,可得到HClO分子的数目是0.1NA | |
| D. | 1 mol Na2O2固体中含离子总数为4NA |
①核电荷数、②核外电子层数、③最外层电子数、④核内质子数.
| A. | ①② | B. | ③④ | C. | ①②④ | D. | ①④ |
 某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.