题目内容
14.SO2溶于水后所得的溶液的性质是 ( )| A. | 有氧化性、无还原性、无酸性 | B. | 无氧化性、有还原性、无酸性 | ||
| C. | 有氧化性、有还原性、有酸性 | D. | 有氧化性、无还原性、有酸性 |
分析 二氧化硫溶液水,与水反应生成亚硫酸,亚硫酸电离生成氢离子,亚硫酸中硫元素处于+4价化合价可以升高,也可以降低,据此判断其性质.
解答 解:二氧化硫溶液水,与水反应生成亚硫酸,亚硫酸电离生成氢离子,所以溶液具有酸性,亚硫酸中硫元素处于+4价化合价可以升高,也可以降低,既有氧化性又有还原性,
故选:C.
点评 本题考查了物质的性质,熟悉二氧化硫、亚硫酸的性质是解题关键,注意分析物质的氧化性、还原性应从化合价入手.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.如图所示与对应的叙述一致的是( )
| A. |  在新型催化剂作用下利用太阳能使水分解的能量变化曲线 | |
| B. |  KNO3溶解度曲线,α点所示溶液为50℃时的不饱和溶液 | |
| C. |  常温下pH=2的HCl溶液加水稀释倍数与pH的变化关系 | |
| D. |  10ml 0.01ml/L KMnO4酸性溶液与过量的0.1mol/L H2C2O4溶液混合时,n(Mn2+)随时间的变化(Mn2+对该反应有催化作用) |
5.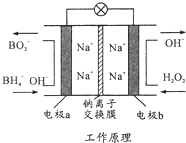 某新型电池,以NaBH4(B的化合价为+3价)和H2O2做原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法正确的是( )
某新型电池,以NaBH4(B的化合价为+3价)和H2O2做原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法正确的是( )
 某新型电池,以NaBH4(B的化合价为+3价)和H2O2做原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法正确的是( )
某新型电池,以NaBH4(B的化合价为+3价)和H2O2做原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法正确的是( )| A. | 电池工作时Na+从b极区移向a极区 | |
| B. | a极上的电极反应式为BH4-+8OH--8e-=BO2- | |
| C. | b极上的电极反应式为H2O2+2e-+2H+=2H2O | |
| D. | 每消耗3molH2O2,转移3mol e- |
2.把氢氧化钠溶液和硫酸铜溶液加入某病人的尿液中,微热时如果观察到红色沉淀,说明该病人的尿液中含有( )
| A. | 食醋 | B. | 酒精 | C. | 食盐 | D. | 葡萄糖 |
9.下列离子方程式书写正确的是( )
| A. | 碳酸氢铵和足量的氢氧化钠溶液反应:NH4++OH-=NH3↑+H2O | |
| B. | 三氯化铁溶液中通入硫化氢气体:2Fe3++H2S=2Fe2++S↓+2H+ | |
| C. | 用稀硝酸浸泡做过银镜反应的试管:Ag+2H++NO3-=Ag++NO2↑+H2O | |
| D. | 偏铝酸钠溶液中通入过量的二氧化碳气体:2AlO2-+CO2+2H2O=2Al(OH)3↓+CO32- |
6.用石墨作电极电解100mL只含有以下离子(未考虑水的电离)的溶液.
①表中x=2.
②电解一段时间后,当阴极收集到0.3mol的气体时(忽略电极产物可能存在的溶解现象),收集到O2的物质的量为0.1mol.
| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/mol•L-1 | 1 | 6 | 4 | x |
②电解一段时间后,当阴极收集到0.3mol的气体时(忽略电极产物可能存在的溶解现象),收集到O2的物质的量为0.1mol.
3.次磷酸(H3PO2)是一种精细磷化工产品,属于一元弱酸,具有较强的还原性.下列有关说法正确的是( )
| A. | H3PO2溶于水的电离方程式为:H3PO2?3H++PO23- | |
| B. | H3PO2与过量NaOH溶液反应的离子方程式为:H3PO2+3OH-=PO23-+3H2O | |
| C. | 将H3PO2溶液加入到酸性高锰酸钾溶液中,H3PO2的还原产物为H3PO4 | |
| D. | 用惰性电极电解NaH2PO2溶液,其阳极反应式为:H2PO2-4e-+2H2O=O2↑+4H+ |
4.化学实验中,常将溶液或试剂进行酸化,下列酸化处理的措施中正确的是( )
| A. | 定性检验SO32-,可用HNO3酸化的BaCl2溶液 | |
| B. | 配制FeCl2溶液时通常加少量HNO3酸化,减小其水解程度 | |
| C. | 检验某溶液中是否含Cl-,用HNO3酸化的AgNO3溶液 | |
| D. | 检验氧化铁中的氧化亚铁,先用硫酸溶液溶解,然后加入盐酸酸化的高锰酸钾溶液 |