��Ŀ����
������Ʒ�������п�����������������Ʒ�ı�������һ�����ܵ�Fe3O4��ijѧϰС��Ϊ���о�������Ƭ���ֱ����������ʵ�������
��1����һ����������Ƭ�ӹ��ɾ��ȷ�ĩ��
��2��ȡm g�÷�ĩ������28.00mL 1mol/L���������У�ǡ����ȫ��Ӧ�����ɱ�״���µ�����134.4mL������Һ�е���KSCN��Һ������������
��3����ȡ���ݲ�ͬ�����ķ�ĩ���ּӼӵ���ͬ�����V�������ʵ���Ũ�Ⱦ�Ϊl0.00mol/L������������Һ�У���ַ�Ӧ����ȫ���ܽ⣬�йص�ʵ�����������ʾ������NO�������Ψһ��ԭ�����
������и��⣺
��ʵ�飨2��������Һ�е������� ��д��ѧʽ������Ʒ��n��Fe����n��Fe3O4��= ��m= ��
�����ʵ�飨3����ÿ��������Һ�������V�� ��mL����
������ʵ���������Һ�м�������ͭ�ۣ�Ҫʹ��Һ��Cu2ʮ��Fe2+��Fe3+ͬʱ���ڣ������ͭ�۵����ʵ����ķ�Χ ��
��1����һ����������Ƭ�ӹ��ɾ��ȷ�ĩ��
��2��ȡm g�÷�ĩ������28.00mL 1mol/L���������У�ǡ����ȫ��Ӧ�����ɱ�״���µ�����134.4mL������Һ�е���KSCN��Һ������������
��3����ȡ���ݲ�ͬ�����ķ�ĩ���ּӼӵ���ͬ�����V�������ʵ���Ũ�Ⱦ�Ϊl0.00mol/L������������Һ�У���ַ�Ӧ����ȫ���ܽ⣬�йص�ʵ�����������ʾ������NO�������Ψһ��ԭ�����
| ʵ����� | �� | �� | �� |
| �����ĩ����/g | 13.68 | 27.36 | 34.20 |
| ����������������״����/L | 2.912 | 5.824 | 6.720 |
��ʵ�飨2��������Һ�е�������
�����ʵ�飨3����ÿ��������Һ�������V��
������ʵ���������Һ�м�������ͭ�ۣ�Ҫʹ��Һ��Cu2ʮ��Fe2+��Fe3+ͬʱ���ڣ������ͭ�۵����ʵ����ķ�Χ
���㣺����ʵ�鷽�������
ר�⣺ʵ����
��������3��������Ʒ�������п�����������������Ʒ�ı�������һ�����ܵ�Fe3O4��ȡm g�÷�ĩ������28.00mL 1mol/L���������У�ǡ����ȫ��Ӧ�����ɱ�״���µ�����134.4mL��˵���������������ᷴӦ��������������Һ�е���KSCN��Һ������������˵���������Ӵ��ڣ���Һ��ֻ���Ȼ�������������Ԫ���غ������Ԫ�����ʵ�����
��������ʵ�飬ͨ��Ͷ���ĩ�����������������������ϵ��֪����Ϊ�����������Ϊ��ĩ��������ͨ��ʵ���������������������NO�������Ψһ��ԭ����Ҳ�������������ʵ���Ϊ
=0.3mol����NԪ�صõ�������Ϊ0.3mol��3=0.9mol�����ڢ��л��������Ϊ34.2g����n��Fe����n��Fe3O4��=4��1����FeΪ0.3mol��Fe3O4Ϊ0.075mol�����ڵ�Ԫ�صõ���������Ϊ0.9mol������Һ��ΪFe��NO3��2��Fe��NO3��3�������ʣ������֪Fe��NO3��2Ϊ0.075mol��Fe��NO3��3Ϊ0.45mol�����ݵ�Ԫ���غ�������������
��27.36g ��ĩ������n��Fe����n��Fe3O4��=4��1��֪����Ԫ��0.42mol�������������������Ϊ����������II��Ӧ��������1.52 mol�����Ṳ1.8mol������II��Һ����Fe3+ 0.42 mol����������0.28mol����ϻ�ѧ��Ӧ������ϵ����ȡֵ��Χ��
��������ʵ�飬ͨ��Ͷ���ĩ�����������������������ϵ��֪����Ϊ�����������Ϊ��ĩ��������ͨ��ʵ���������������������NO�������Ψһ��ԭ����Ҳ�������������ʵ���Ϊ
| 6.720L |
| 22.4L/mol |
��27.36g ��ĩ������n��Fe����n��Fe3O4��=4��1��֪����Ԫ��0.42mol�������������������Ϊ����������II��Ӧ��������1.52 mol�����Ṳ1.8mol������II��Һ����Fe3+ 0.42 mol����������0.28mol����ϻ�ѧ��Ӧ������ϵ����ȡֵ��Χ��
���
�⣺��3������������Һ�е���KSCN��Һ�������������֪��Ӧ�����ɵ�����ΪFeCl2�����ڷ����������Ϊ0.028L��1 mol/L=0.028mol�������������غ㣬�ʲ���FeCl2�����ʵ���Ϊ0.014mol�����е������ֱ������ᡢFe3O4���߷�����Ӧ���������ɱ�״���µ�����134.4 mL�����ʵ���=
=0.006mol�����ݻ�ѧ��Ӧ������ϵ��֪��������������ᷢ����������ĵ�����Ϊ0.006mol����Fe3O4��Fe��HCl��ͬ��Ӧ���ڸ÷�Ӧ����Ԫ������Ϊ��0.014mol-0.006mol=0.008mol���Ҹ÷�Ӧ����ʽΪFe3O4+8HCl+Fe=4FeCl2+4H2O��ͨ���÷�Ӧ����ʽ��֪Fe3O4Ϊ0.002mol�������÷�Ӧ�ĵ�����Ϊ0.002mol�����ܵ�Fe���ʵ���Ϊ0.008mol��Fe3O4Ϊ0.002mol������Ʒ��n��Fe����n��Fe3O4��=4��1������Ϊ0.002mol��232g/mol+0.008mol��56g/mol=0.912g��
�ʴ�Ϊ��FeCl2��4��1��0.912g��
��������ʵ�飬ͨ��Ͷ���ĩ�����������������������ϵ��֪����Ϊ�����������Ϊ��ĩ��������ͨ��ʵ���������������������NO�������Ψһ��ԭ����Ҳ�������������ʵ���Ϊ
=0.3mol����NԪ�صõ�������Ϊ0.3mol��3=0.9mol�����ڢ��л��������Ϊ34.2g����n��Fe����n��Fe3O4��=4��1����FeΪ0.3mol��Fe3O4Ϊ0.075mol�����ڵ�Ԫ�صõ���������Ϊ0.9mol������Һ��ΪFe��NO3��2��Fe��NO3��3�������ʣ������֪Fe��NO3��2Ϊ0.075mol��Fe��NO3��3Ϊ0.45mol������Һ�����������Ϊ0.075mol��2+0.45mol��3=1.5mol����÷�Ӧ��NԪ�������ʵ���Ϊ1.5mol+0.3mol=1.8mol������������Ϊ180ml��
�ʴ�Ϊ��180��
��27.36g ��ĩ������n��Fe����n��Fe3O4��=4��1��֪����Ԫ��0.42mol�������������������Ϊ����������II��Ӧ��������1.52 mol�����Ṳ1.8mol������II��Һ����Fe3+ 0.42 mol����������0.28mol��
3Cu��8HNO3 Cu��2Fe3+
3 8 1 2
nmin 0.28mol n 0.42
nmin=0.105mol
n=0.21mol
nmax =0.21mol+0.105mol=0.315mol
����ʵ���������Һ�м�������ͭ�ۣ�Ҫʹ��Һ��Cu2ʮ��Fe2+��Fe3+ͬʱ���ڣ������ͭ�۵����ʵ����ķ�Χ0.105mol��n��Cu����0.315mol��
�ʴ�Ϊ��0.105mol��n��Cu����0.315mol��
| 0.1344L |
| 22.4L/mol |
�ʴ�Ϊ��FeCl2��4��1��0.912g��
��������ʵ�飬ͨ��Ͷ���ĩ�����������������������ϵ��֪����Ϊ�����������Ϊ��ĩ��������ͨ��ʵ���������������������NO�������Ψһ��ԭ����Ҳ�������������ʵ���Ϊ
| 6.720L |
| 22.4L/mol |
�ʴ�Ϊ��180��
��27.36g ��ĩ������n��Fe����n��Fe3O4��=4��1��֪����Ԫ��0.42mol�������������������Ϊ����������II��Ӧ��������1.52 mol�����Ṳ1.8mol������II��Һ����Fe3+ 0.42 mol����������0.28mol��
3Cu��8HNO3 Cu��2Fe3+
3 8 1 2
nmin 0.28mol n 0.42
nmin=0.105mol
n=0.21mol
nmax =0.21mol+0.105mol=0.315mol
����ʵ���������Һ�м�������ͭ�ۣ�Ҫʹ��Һ��Cu2ʮ��Fe2+��Fe3+ͬʱ���ڣ������ͭ�۵����ʵ����ķ�Χ0.105mol��n��Cu����0.315mol��
�ʴ�Ϊ��0.105mol��n��Cu����0.315mol��
���������⿼�����������ʵ�ʵ����ƺ��̷����жϣ���Ҫ��Ԫ���غ㣬��Ӧ���̷����ļ��㷽�������������Ϣ�����������ǽ���ؼ�����Ŀ�ѶȽϴ�

��ϰ��ϵ�д�
 A�ӽ��� ϵ�д�
A�ӽ��� ϵ�д� ȫ�Ų��Ծ�ϵ�д�
ȫ�Ų��Ծ�ϵ�д�
�����Ŀ
�������ӷ���ʽ��д��ȷ���ǣ�������
| A��Na��H2O��Ӧ��Na+H2O=Na++OH-+H2�� | ||
| B��NH4HCO3��Һ������NaOH��Һ��ϣ�HCO3-+OH-=CO32-+H2O | ||
| C����С�մ�����θ����ࣺCO32-+2H+=CO2��+H2O | ||
D�������������������������Һ��Ӧ��CH2BrCOOH+NaOH
|
��298Kʱ��NaCl ��ˮ�е��ܽ��Ϊ
ˮ���罫1molNaCl�ܽ���1Lˮ�У����ܽ��������ϵ�ġ�H-T��S������α仯��������
| 26g |
| 100g |
| A����H-T��S��0��S��0 |
| B����H-T��S��0��S��0 |
| C����H-T��S��0��S��0 |
| D����H-T��S��0��S��0 |
������������ԭ���������ǣ�������
| A�����³�ѹ��28gCO |
| B����״����22.4LN2 |
| C������4molH��CH4 |
| D��NA ��NO���� |
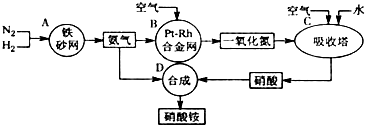
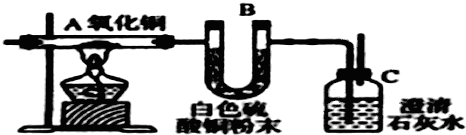
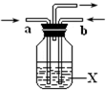 A��B��C��D��E��F��G��H����Է�������������������壬���Ǿ��ɶ�����Ԫ����ɣ������������ʣ�
A��B��C��D��E��F��G��H����Է�������������������壬���Ǿ��ɶ�����Ԫ����ɣ������������ʣ�