题目内容
相同分子数的SO2和CO2中,相等的是( )
| A、原子总数 |
| B、电子个数 |
| C、物质质量 |
| D、氧元素的质量分数 |
考点:物质分子中的原子个数计算
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.SO2和CO2都含有3个原子;
B.SO2的电子数为32,CO2的电子数为22;
C.SO2的摩尔质量为64g/mol,CO2的摩尔质量为44g/mol;
D.SO2中氧元素的质量分数为
=0.5,CO2中氧元素的质量分数为
0.727.
B.SO2的电子数为32,CO2的电子数为22;
C.SO2的摩尔质量为64g/mol,CO2的摩尔质量为44g/mol;
D.SO2中氧元素的质量分数为
| 32 |
| 64 |
| 32 |
| 44 |
解答:
解:A.SO2和CO2都含有3个原子,故相同分子数目的SO2和CO2中所含的原子数相同,故A正确;
B.SO2的电子数为32,CO2的电子数为22,故相同分子数目的SO2和CO2中所含的电子数不相同,故B错误;
C.SO2的摩尔质量为64g/mol,CO2的摩尔质量为44g/mol,故相同分子数目的SO2和CO2的质量不相同,故C错误;
D.SO2中氧元素的质量分数为
=0.5,CO2中氧元素的质量分数为
0.727,故相同分子数目的SO2和CO2中氧元素的质量分数不相同,故D错误;
故选A.
B.SO2的电子数为32,CO2的电子数为22,故相同分子数目的SO2和CO2中所含的电子数不相同,故B错误;
C.SO2的摩尔质量为64g/mol,CO2的摩尔质量为44g/mol,故相同分子数目的SO2和CO2的质量不相同,故C错误;
D.SO2中氧元素的质量分数为
| 32 |
| 64 |
| 32 |
| 44 |
故选A.
点评:本题考查物质中所含微粒数目的计算,难度中等.把握阿伏伽德罗定律的应用是解题的关键.

练习册系列答案
 学习实践园地系列答案
学习实践园地系列答案
相关题目
室温下,分别在pH=1的酸和pH=14的NaOH溶液中加入足量的铝,放出H2的量前者多,其原因可能是( )
①溶液的体积相同,酸是多元强酸
②两溶液的体积相同,酸是一元弱酸
②酸溶液的体积大于NaOH溶液的体积
④酸是强酸,浓度比NaOH溶液的大.
①溶液的体积相同,酸是多元强酸
②两溶液的体积相同,酸是一元弱酸
②酸溶液的体积大于NaOH溶液的体积
④酸是强酸,浓度比NaOH溶液的大.
| A、①② | B、②③ | C、② | D、④ |
 图是最简单的铜-锌原电池.对于该原电池,下列说法中不正确的是( )
图是最简单的铜-锌原电池.对于该原电池,下列说法中不正确的是( )①Zn为正极,Cu为负极.
②电解质溶液的pH不变.
③电子流动方向为:Zn→Cu.④Cu极上有H2生成.
⑤若有1mol电子流过导线,则产生H2 0.5mol.
⑥该原电池生成氢气的速度比没有连导线时慢.
| A、①②③ | B、③④⑤ |
| C、①②⑥ | D、④⑤⑥ |
下列各物质中所含原子个数由大到小的顺序排列正确的是( )
(1)0.5mol NH3(2)1mol Ne (3)9g H2O (4)0.2mol H3PO4.
(1)0.5mol NH3(2)1mol Ne (3)9g H2O (4)0.2mol H3PO4.
| A、(1)(4)(3)(2) |
| B、(4)(3)(2)(1) |
| C、(2)(3)(4)(1) |
| D、(1)(4)(2)(3) |
以下有关化学用语描述正确的是( )
| A、Mg2+的电子排布式:1s22s22p63s2 |
B、NH4Cl的电子式: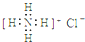 |
| C、乙烯的结构简式:C2H4 |
| D、氨气的空间结构:三角锥形 |
下列说法正确的是( )
| A、共价化合物中可能含有离子键 |
| B、区别离子化合物和共价化合物的方法是看其水溶液是否能够导电 |
| C、离子化合物中只含有离子键 |
| D、离子化合物熔融状态能电离出自由移动的离子,而共价化合物不能 |
下列叙述不正确的是( )
| A、在标准状况下,将22.4L氨气溶于1L水中,得到1mol?L-1的氨水 |
| B、配制0.1mol?L-1的Na2CO3溶液480mL,需用500mL容量瓶 |
| C、10mL质量分数为98%的H2SO4,用10mL水稀释后,H2SO4的质量分数大于49% |
| D、向2等份不饱和的烧碱溶液中分别加入一定量的Na2O2、和Na2O,使溶液均恰好饱和则加入的Na2O2与Na2O的物质的量之比等于1:1(温度不变) |
用标准盐酸溶液滴定未知浓度的NaOH溶液,下列各操作中,会引起实验误差的是( )
| A、取干燥洁净的酸式滴定管立即装入标准盐酸 |
| B、用蒸馏水洗净锥形瓶后,立即装入一定体积的NaOH溶液后进行滴定 |
| C、往盛有20.00mL NaOH溶液的锥形瓶中,滴入几滴酚酞指示剂后进行滴定 |
| D、用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,然后装入一定体积的NaOH溶液 |