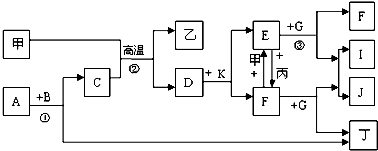
题目内容
实验室用铜制备CuSO4溶液有多种方案,某实验小组给出了以下三种方案:

请回答有关问题:
(1)甲方案:
①写出该反应的离子方程式 ;
②为了节约原料,硫酸和硝酸的物质的量之比最佳为,n(H2SO4):n(HNO3)= .
(2)乙方案:将6.4g铜丝放到90mL 1.5mol?L-1的稀硫酸中,控温在50℃.加入40mL 10%的H2O2,反应0.5小时,升温到60℃,持续反应1小时后,经一系列操作,得CuSO4?5H2O 20.0g
【已知有关摩尔质量:M(Cu)=64g/mol,M(CuSO4?5H2O)=250g/mol】.
①反应时温度控制在50℃~60℃,不宜过高的原因是 ;
②本实验CuSO4?5H2O的产率为 .
(3)丙方案:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应.向反应液中加少量FeSO4,即发生反应,生成硫酸铜.反应完全后,加物质A调节pH至4,然后过滤、浓缩、结晶.
①物质A可选用以下的 (填序号);
A.CaO B.NaOH C.CuCO3 D.Cu2(OH)2CO3 E.Fe2(SO4)3
②反应中加入少量FeSO4可加速铜的氧化,FeSO4的作用是 ;
(4)对比甲、乙、丙三种实验方案,丙方案的优点有(写两条): 、 .

请回答有关问题:
(1)甲方案:
①写出该反应的离子方程式
②为了节约原料,硫酸和硝酸的物质的量之比最佳为,n(H2SO4):n(HNO3)=
(2)乙方案:将6.4g铜丝放到90mL 1.5mol?L-1的稀硫酸中,控温在50℃.加入40mL 10%的H2O2,反应0.5小时,升温到60℃,持续反应1小时后,经一系列操作,得CuSO4?5H2O 20.0g
【已知有关摩尔质量:M(Cu)=64g/mol,M(CuSO4?5H2O)=250g/mol】.
①反应时温度控制在50℃~60℃,不宜过高的原因是
②本实验CuSO4?5H2O的产率为
(3)丙方案:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应.向反应液中加少量FeSO4,即发生反应,生成硫酸铜.反应完全后,加物质A调节pH至4,然后过滤、浓缩、结晶.
①物质A可选用以下的
A.CaO B.NaOH C.CuCO3 D.Cu2(OH)2CO3 E.Fe2(SO4)3
②反应中加入少量FeSO4可加速铜的氧化,FeSO4的作用是
(4)对比甲、乙、丙三种实验方案,丙方案的优点有(写两条):
考点:制备实验方案的设计,铜金属及其重要化合物的主要性质
专题:实验题
分析:(1)①Cu与稀硫酸、稀硝酸混合,Cu被氢离子和硝酸根离子氧化为 铜离子;
②当硝酸根离子恰好反应时硫酸和硝酸的物质的量之比最佳,根据离子方程式计算;
(2)①双氧水不稳定,受热易分解;
②假设Cu完全转化为硫酸铜,根据Cu原子守恒计算生成的硫酸铜晶体的质量,用实际生成的硫酸铜的质量比理论值即是CuSO4?5H2O的产率;
(3)①调节pH时不能引入新的杂质;
②加入少量FeSO4可加速铜的氧化,FeSO4不参与反应,作催化剂;
(4)通过原料的利用率和副产物对环境的影响分析.
②当硝酸根离子恰好反应时硫酸和硝酸的物质的量之比最佳,根据离子方程式计算;
(2)①双氧水不稳定,受热易分解;
②假设Cu完全转化为硫酸铜,根据Cu原子守恒计算生成的硫酸铜晶体的质量,用实际生成的硫酸铜的质量比理论值即是CuSO4?5H2O的产率;
(3)①调节pH时不能引入新的杂质;
②加入少量FeSO4可加速铜的氧化,FeSO4不参与反应,作催化剂;
(4)通过原料的利用率和副产物对环境的影响分析.
解答:
解:(1)①Cu与稀硫酸、稀硝酸混合,Cu被氢离子和硝酸根离子氧化为铜离子,其反应的离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
②当硝酸根离子恰好反应时硫酸和硝酸的物质的量之比最佳,由离子方程式3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O 可知,反应中消耗2molNO3-,需要8molH+,硝酸电离2mol,另外6mol氢离子由硫酸提供,则硫酸为3mol,所以硫酸和硝酸的物质的量之比为3:2,故答案为:3:2;
(2)①双氧水不稳定,受热易分解,所以反应时温度控制在50℃~60℃,不宜过高,防止双氧水分解造成损耗,
故答案为:双氧水受热易分解造成损耗;
②6.4g铜丝即0.1mol,放到90mL 1.5mol?L-1的稀硫酸中,控温在50℃.加入40mL 10%的H2O2,反应0.5小时,升温到60℃,持续反应1小时后,经一系列操作,假设Cu完全转化为硫酸铜,则得CuSO4?5H2O为0.1mol,即m(CuSO4?5H2O)=nM=0.1mol×250g/mol=25.0g,
已知实际上CuSO4?5H2O为 20.0g,则产率为
×100%=80%;
故答案为:80%;
(3)①调节pH时不能引入新的杂质,用NaOH、CaO调节pH会引入钠离子、钙离子,Fe2(SO4)3不能增大溶液的pH,所以选用CuCO3 或Cu2(OH)2CO3;
故答案为:CD;
②加入少量FeSO4可加速铜的氧化,FeSO4不参与反应,所以在制备过程中FeSO4作催化剂;故答案为:作催化剂;
(4)甲方案中会生成NO,会污染环境;乙方案需要加热,消耗双氧水,Cu不能完全转化;丙方案对环境无污染,原料利用率高,故答案:无污染;原料利用率高.
故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
②当硝酸根离子恰好反应时硫酸和硝酸的物质的量之比最佳,由离子方程式3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O 可知,反应中消耗2molNO3-,需要8molH+,硝酸电离2mol,另外6mol氢离子由硫酸提供,则硫酸为3mol,所以硫酸和硝酸的物质的量之比为3:2,故答案为:3:2;
(2)①双氧水不稳定,受热易分解,所以反应时温度控制在50℃~60℃,不宜过高,防止双氧水分解造成损耗,
故答案为:双氧水受热易分解造成损耗;
②6.4g铜丝即0.1mol,放到90mL 1.5mol?L-1的稀硫酸中,控温在50℃.加入40mL 10%的H2O2,反应0.5小时,升温到60℃,持续反应1小时后,经一系列操作,假设Cu完全转化为硫酸铜,则得CuSO4?5H2O为0.1mol,即m(CuSO4?5H2O)=nM=0.1mol×250g/mol=25.0g,
已知实际上CuSO4?5H2O为 20.0g,则产率为
| 20.0g |
| 25.0g |
故答案为:80%;
(3)①调节pH时不能引入新的杂质,用NaOH、CaO调节pH会引入钠离子、钙离子,Fe2(SO4)3不能增大溶液的pH,所以选用CuCO3 或Cu2(OH)2CO3;
故答案为:CD;
②加入少量FeSO4可加速铜的氧化,FeSO4不参与反应,所以在制备过程中FeSO4作催化剂;故答案为:作催化剂;
(4)甲方案中会生成NO,会污染环境;乙方案需要加热,消耗双氧水,Cu不能完全转化;丙方案对环境无污染,原料利用率高,故答案:无污染;原料利用率高.
点评:本题考查了物质制备方案设计和评价,侧重于考查学生的实验探究能力和数据处理能力,注意把握Cu与硝酸、硫酸反应的离子方程式,题目难度中等.

练习册系列答案
相关题目
某温度下,两个密闭容器中发生如下反应:2E(g)?F(g)+x G(g);△H<0分别达到平衡.容器1:起始时E浓度为a mol/L,F、G浓度均为0,达平衡时E的浓度为0.5a mol/L;容器2:E的起始浓度:为2a mol/L,F、G浓度均为0,下列说法正确的是( )
| A、若x=l,两个容器体积相同,则平衡2中E的物质的量为a mol |
| B、若x=1,两个容器压强相同,则平衡2中E的平衡浓度为a mol?L-1 |
| C、若x=2,两个容器体积相同,则平衡2中E的平衡浓度为a mol?L-1 |
| D、若x=2,两个容器压强相同,则平衡2中E的体积分数为50% |
下列实验装置图正确的是( )
A、 实验室制乙烯 |
B、 实验室制氨 |
C、 实验室制氯气 |
D、 实验室制乙酸乙酯 |
在容积固定的密闭容器中存在如下反应:A(g)+3B(g)?2C(g);△H<0.某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:

下列判断一定错误的是( )

下列判断一定错误的是( )
| A、图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高 |
| B、图Ⅱ研究的是压强对反应的影响,且乙的压强较高 |
| C、图Ⅲ研究的是温度对反应的影响,且甲的温度较高 |
| D、图 IV研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高 |