题目内容
X﹑Y﹑Z﹑W为原子序数依次增大的四种短周期元素,其中X元素原子的核外电子总数等于其电子层数,Z元素的气态氢化物和它的氧化物在常温下反应生成Z单质和水,X与Y﹑W可分别形成YX3和XW型共价化合物,YX3极易溶于水.
(1)Y的元素符号是 .
(2)XW的化学式是 .
(3)XW与YX3反应生成一种盐,该盐水溶液的pH 7(填“大于”﹑“小于”或“等于”),其原因是(用离子方程式表示) .
(4)Z元素氢化物的沸点比H2O (填“低”或“高”).Z元素的氢化物有毒,写出用CuSO4溶液吸收Z元素氢化物的离子方程式 .
(5)已知X单质和Y单质反应生成YX3是可逆反应,△H<0.将X﹑Y的两种单质以等物质的量充入一密闭容器中,在适当催化剂和恒温﹑恒压条件下反应.下列说法正确的是 .
A.达到化学平衡时,任何一种物质的正反应速率与逆反应速率相等
B.反应过程中,Y单质的体积分数始终为50%
C.达到化学平衡时,X﹑Y两种单质在混合气体中的物质的量之比为1:1
D.达到化学平衡的过程中气体平均相对分子质量减小
E.达到化学平衡后,升高温度,YX3的体积分数增大.
(1)Y的元素符号是
(2)XW的化学式是
(3)XW与YX3反应生成一种盐,该盐水溶液的pH
(4)Z元素氢化物的沸点比H2O
(5)已知X单质和Y单质反应生成YX3是可逆反应,△H<0.将X﹑Y的两种单质以等物质的量充入一密闭容器中,在适当催化剂和恒温﹑恒压条件下反应.下列说法正确的是
A.达到化学平衡时,任何一种物质的正反应速率与逆反应速率相等
B.反应过程中,Y单质的体积分数始终为50%
C.达到化学平衡时,X﹑Y两种单质在混合气体中的物质的量之比为1:1
D.达到化学平衡的过程中气体平均相对分子质量减小
E.达到化学平衡后,升高温度,YX3的体积分数增大.
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X、Y、M、Z、W为原子序数依次增大的五种短周期元素,其中X原子的电子层数与它的核外电子总数相同,则X为氢元素;Z元素的气态氢化物和它的氧化物在常温下反应生成Z单质和水,则Z为S元素,X与Y、W可分别形成YX3和XW型共价化合物,YX3极易溶于水,所以Y为N元素,W为Cl元素,据此回答问题.
解答:
解:X、Y、M、Z、W为原子序数依次增大的五种短周期元素,其中X原子的电子层数与它的核外电子总数相同,则X为H元素;Z元素的气态氢化物和它的氧化物在常温下反应生成Z单质和水,则Z为S元素,X与Y、W可分别形成YX3和XW型共价化合物,YX3极易溶于水,所以Y为N元素,W为Cl元素,
(1)由上分析,Y的元素符号是N,故答案为:N;
(2)X为H,W为Cl,XW的化学式是HCl,故答案为:HCl;
(3)XW与YX3反应生成一种盐为氯化铵,属于强酸弱碱盐,水解离子方程式为NH4++H2O?NH3?H2O+H+,溶液呈酸性,故答案为:<;NH4++H2O?NH3?H2O+H+;
(4)Z元素氢化物为H2S,分子间无氢键,H2O分子间形成氢键,使H2O得熔沸点增大,故H2S沸点比H2O的低,CuSO4溶液吸收H2S的离子方程式为H2S+Cu2+=2H++CuS↓,故答案为:低;H2S+Cu2+=2H++CuS↓;
(5)由N2+3H2
2NH3 △H<0,
A.由化学平衡的特征可知,达到化学平衡时,正反应速率与逆反应速率相等,故A正确;
B.等物质的量的Y、Z两种单质反应,设均为n则
N2+3H2
2NH3
开始 n n 0
转化 x 3x 2x
平衡 n-x n-3x 2x
则Y单质的体积分数为
×100%=50%,故B正确;
C.Y、Z以1:3的体积比转化,则达到化学平衡时,Y、Z两种单质在混合气体中的物质的量之比不能为1:1,故C错误;
D.由质量守恒可知,质量不变,但反应中气体的物质的量减小,则由M=
可知达到化学平衡的过程中气体平均相对分子质量增大,故D错误;
E.反应为放热反应,升高温度逆向移动,则达到化学平衡后,升高温度,C的体积分数减小,故E错误;
故选AB.
(1)由上分析,Y的元素符号是N,故答案为:N;
(2)X为H,W为Cl,XW的化学式是HCl,故答案为:HCl;
(3)XW与YX3反应生成一种盐为氯化铵,属于强酸弱碱盐,水解离子方程式为NH4++H2O?NH3?H2O+H+,溶液呈酸性,故答案为:<;NH4++H2O?NH3?H2O+H+;
(4)Z元素氢化物为H2S,分子间无氢键,H2O分子间形成氢键,使H2O得熔沸点增大,故H2S沸点比H2O的低,CuSO4溶液吸收H2S的离子方程式为H2S+Cu2+=2H++CuS↓,故答案为:低;H2S+Cu2+=2H++CuS↓;
(5)由N2+3H2
| ||
| 高温高压 |
A.由化学平衡的特征可知,达到化学平衡时,正反应速率与逆反应速率相等,故A正确;
B.等物质的量的Y、Z两种单质反应,设均为n则
N2+3H2
| ||
| 高温高压 |
开始 n n 0
转化 x 3x 2x
平衡 n-x n-3x 2x
则Y单质的体积分数为
| n-x |
| (n-x)+(n-3x)+2x |
C.Y、Z以1:3的体积比转化,则达到化学平衡时,Y、Z两种单质在混合气体中的物质的量之比不能为1:1,故C错误;
D.由质量守恒可知,质量不变,但反应中气体的物质的量减小,则由M=
| m |
| n |
E.反应为放热反应,升高温度逆向移动,则达到化学平衡后,升高温度,C的体积分数减小,故E错误;
故选AB.
点评:本题为综合性题,考查原子结构与元素周期律、化学平衡等主要知识点,难度较大,根据信息来推断元素是解答本题的关键.

练习册系列答案
相关题目
如图为周期表中短周期的一部分,若X原子最外层电子数比次外层电子数少3,则下列说法正确的是( )
| R | ||
| X | Y | Z |
| A、X的氢化物比Z的氢化物稳定 |
| B、原子半径大小顺序是Z>Y>X |
| C、Y、R形成的化合物YR3能使酸性KMnO4溶液褪色 |
| D、X、Z可形成化合物XZ3,分子中各原子均满足最外层8电子的稳定结构 |
为了除去MgCl2溶液中的FeCl3,可在加热搅拌的条件下加入的一种试剂是( )
| A、NaOH |
| B、MgCO3 |
| C、氨水 |
| D、铁粉 |
下列各组混合物的物质的量均为a mol,组内物质按任意比例混合,完全燃烧时消耗O2的物质的量不变的是( )
| A、甲醇、甲醛 |
| B、苯、1,3-丁二烯 |
| C、丙烯、2-丁烯 |
| D、乙醇、乙烯 |

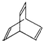
 .有机物X的键线式为:
.有机物X的键线式为: