题目内容
1.10g碳酸钙溶于100ml盐酸溶液,恰好完全反应.写出该反应的离子方程式CaCO3 +2H+═Ca2++H2O+CO2↑,标准状况下生成气体体积2.24L,盐酸的物质的量的浓度2mol/L.分析 10g碳酸钙溶于100ml盐酸溶液,恰好完全反应,根据方程式:CaCO3 +2HCl═CaCl2+H2O+CO2↑,利用消耗的碳酸钙的量进行计算即可.
解答 解:10g即0.1mol碳酸钙溶于100ml盐酸溶液,恰好完全反应,根据方程式:CaCO3 +2H+═Ca2++H2O+CO2↑,得到碳酸钙的物质的量是0.1mol,体积是0.1mol×22.4L/mol=2.24L,消耗盐酸的物质的量是0.2mol,则盐酸的物质的量的浓度是$\frac{0.2mol}{0.1L}$=2mol/L,
故答案为:CaCO3 +2H+═Ca2++H2O+CO2↑;2.24;2.
点评 本题考查学生化学方程式的计算以及物质的量有关公式的灵活应用知识,注意知识的迁移应用是关键,难度不大.

练习册系列答案
相关题目
11.初中常见的3种元素X、Y和Z的相关信息如下表所示.
请用元素符号或化学式回答下列问题:
(1)Z的元素符号是O.
(2)X的元素原子容易变成X+,其原因是金属性强.
(3)Y的单质与不充足的Z的单质反应,其产物的化学式为CO.
(4)YZ2可与X的氢氧化物发生反应,该反应的化学方程式为CO2+2NaOH=Na2CO3+H2O.
(5)由X、Y、Z三种元素组成的化合物与一定量的稀盐酸混合后的现象为有气体生成,该反应的化学方程式为Na2CO3+2HCl=2NaCl+H2O+CO2↑.
| 元素 | X | Y | Z |
| 相关 信息 | 食盐中存在的 金属元素 | 其一种单质是天然 存在的最硬的物质 | 地壳中含量 最多的元素 |
(1)Z的元素符号是O.
(2)X的元素原子容易变成X+,其原因是金属性强.
(3)Y的单质与不充足的Z的单质反应,其产物的化学式为CO.
(4)YZ2可与X的氢氧化物发生反应,该反应的化学方程式为CO2+2NaOH=Na2CO3+H2O.
(5)由X、Y、Z三种元素组成的化合物与一定量的稀盐酸混合后的现象为有气体生成,该反应的化学方程式为Na2CO3+2HCl=2NaCl+H2O+CO2↑.
12.某溶液中有:①Cu2+、②NH4+、③Fe2+、④Al3+四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再向其中加入过量盐酸,溶液中大量减少的阳离子是( )
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
9.向一定量的 Fe、FeO 和 Fe2O3的混合物中加入 150mL 4mol/L 的稀硝酸,恰好使混合物 完全溶解,放出 1.792L NO(标准状况),往所得溶液中加入 NH4SCN 溶液,无红色出现.若 用足量的氢气在加热下还原相同质量的混合物,能得到铁的物质的量为( )
| A. | 0.26mol | B. | 0.28 mol | C. | 0.30 mol | D. | 0.32 mol |
6.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 将100 mL 0.1 mol•L-1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒数目为0.01NA | |
| B. | Na2O2与足量的水反应生成1 mol O2,转移电子数目为2NA | |
| C. | 某密闭容器中有2 mol SO2和1 mol O2,在一定条件下充分反应,转移的电子数为4NA | |
| D. | 18 g重水(D2O)所含的电子数为NA |
13.实验室中的药品常按物质的性质、类别等有规律地摆放.现有部分药品按某种规律的摆放在实验桌上,如下图.做“硫酸的性质”的实验时,某同学取用BaCl2溶液后,应把它放回的位置是( )
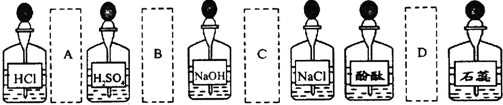

| A. | A | B. | B | C. | C | D. | D |
10.能把稀硫酸、氢氧化钠和氯化钠三种溶液一次性鉴别出来的试剂是( )
| A. | 紫色石蕊溶液 | B. | 无色酚酞溶液 | C. | 碳酸钠溶液 | D. | 硝酸钾溶液 |
11.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 16g O2和O3的混合气体中含有的原子数为NA | |
| B. | 在1L0.1 mol/L碳酸钠溶液中,CO32-总数为0.1 NA | |
| C. | 标准状况下,22.4 LSO3与水反应生成1mol硫酸 | |
| D. | 标准状况下,22.4L Cl2完全发生氧化还原反应一定转移2NA个电子 |