题目内容
9.向一定量的 Fe、FeO 和 Fe2O3的混合物中加入 150mL 4mol/L 的稀硝酸,恰好使混合物 完全溶解,放出 1.792L NO(标准状况),往所得溶液中加入 NH4SCN 溶液,无红色出现.若 用足量的氢气在加热下还原相同质量的混合物,能得到铁的物质的量为( )| A. | 0.26mol | B. | 0.28 mol | C. | 0.30 mol | D. | 0.32 mol |
分析 混合物与硝酸反应时恰好使混合物完全溶解,且所得溶液中加入NH4SCN溶液,无血红色出现,说明溶液中的溶质为硝酸亚铁,由铁元素守恒可知,足量的氢气在加热下还原相同质量的混合物,得到铁的物质的量与硝酸亚铁中的铁的物质的量相同,根据硝酸的物质的量和生成NO的物质的量,求出溶液中硝酸亚铁的物质的量.
解答 解:因一定量的 Fe、FeO和 Fe2O3的混合物中加入150mL 4mol/L的稀硝酸,恰好使混合物完全溶解,所得溶液中加入NH4SCN溶液,无血红色出现,则溶液中的溶质为Fe(NO3)2,
1.792L NO(标准状况)的物质的量为:$\frac{1.792L}{22.4L/mool}$=0.08mol,根据氮元素守恒,硝酸亚铁中的硝酸根离子的物质的量为:0.15L×4mol/L-0.08mol=0.52mol,所以硝酸亚铁的物质的量为:$\frac{0.52mol}{2}$=0.26mol,由铁元素守恒可知,用足量的氢气在加热下还原相同质量的混合物,能得到铁的物质的量为:n(Fe)=n[Fe(NO32)]=0.26mol,
故选A.
点评 本题混合物反应的计算,题目难度不大,明确硝酸亚铁与硝酸的关系、硝酸亚铁中铁元素与原混合物中的铁元素的关系是解答的关键,注意掌握守恒思想在化学计算中的应用方法,试题培养了学生的化学计算能力.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
19.下列装置中能组成原电池产生电流的是( )
| A. |  | B. |  | C. |  | D. |  |
20.乳酸在一定条件下所形成的聚酯的结构简式为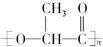 ,该酯可以作为新型的餐具原料.由它所产生的塑料在乳酸菌作用下,能迅速分解为无毒物质,可以降解.下列有关这种新型的可降解塑料的叙述正确的是( )
,该酯可以作为新型的餐具原料.由它所产生的塑料在乳酸菌作用下,能迅速分解为无毒物质,可以降解.下列有关这种新型的可降解塑料的叙述正确的是( )
 ,该酯可以作为新型的餐具原料.由它所产生的塑料在乳酸菌作用下,能迅速分解为无毒物质,可以降解.下列有关这种新型的可降解塑料的叙述正确的是( )
,该酯可以作为新型的餐具原料.由它所产生的塑料在乳酸菌作用下,能迅速分解为无毒物质,可以降解.下列有关这种新型的可降解塑料的叙述正确的是( )| A. | 降解塑料是一种纯净物 | |
| B. | 其生产过程中的聚合方式与聚苯乙烯相似 | |
| C. | 它属于一种线型高分子材料 | |
| D. | 其相对分子质量为72 |
14.下列说法正确的是( )
| A. | 取少许某溶液,滴加数滴KSCN溶液,无明显现象;再另取少许原溶液,先滴少量新制氯水,再滴加数滴KSCN溶液,溶液变血红色,则原溶液中一定含Fe2+ | |
| B. | 焰色反应时,用稀硫酸洗净铂丝,并在火焰上灼烧至无色,然后蘸取溶液 | |
| C. | 在淀粉溶液中加入稀硫酸并加热片刻后,再加入适量银氨溶液,水浴加热后没有银镜生成,说明淀粉没有水解 | |
| D. | 测定某溶液的pH,常用干燥洁净的玻璃棒蘸取该溶液滴在润湿的pH试纸上 |
18.下列有关阿伏加德罗常数(NA)的说法错误的是( )
| A. | 16 g O2所含的原子数目为NA | |
| B. | 0.5 mol H2O2含有的原子数目为1.5NA | |
| C. | 1 mol H2O含有的H2O分子数目为NA | |
| D. | 0.5NA个氯气分子的物质的量是0.5 mol |
19.实验室制备下列气体时,所用方法正确的是( )
| A. | 制氧气时,用Na2O2或H2O2做反应物可选择相同的气体发生装置 | |
| B. | 制氯气时,用饱和NaHCO3和浓硫酸净化气体 | |
| C. | 制氨气时,用排水法或向上排空气法收集气体 | |
| D. | 制二氧化氮时,用水或NaOH溶液吸收尾气 |
 .
.