题目内容
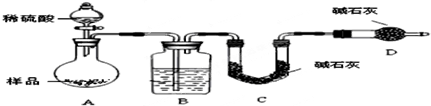
Na2S2O3.5H2O(俗称海波)是照相业常用的一种试剂.工业上制得的Na2S2O3.5H2O晶体中可能含有少量的Na2SO3和Na2SO4杂质.为了测定某海波样品的成分,称取三份质量不同的该样品,分别加入相同浓度的硫酸溶液30.00mL,充分反应后滤出硫,微热滤液使生成的SO2全部逸出.(已知:Na2S2O3+H2SO4═Na2SO4+SO2↑+S↓+H2O)
测得有关实验数据如下(标准状况):
(已知物质的摩尔质量:Na2S2O3.5H2O 248g/mol;Na2SO3 126g/mol;Na2SO4 142g/mol)
(1)计算所用硫酸溶液的物质的量浓度.
(2)分析以上数据,该样品中 (填写选项字母)
A.仅含有Na2S2O3?5H2O
B.含有Na2S2O3?5H2O 和Na2SO3,无Na2SO4
C.含有Na2S2O3?5H2O、Na2SO3和Na2SO4
(3)若将22.62g该样品和一定量的上述硫酸溶液混合微热.试讨论:当加入硫酸的体积(aL)在不同取值范围时,生成的SO2体积(bL)的值(可用含a的关系式表示)
测得有关实验数据如下(标准状况):
| 第一份 | 第二份 | 第三份 | |
| 样品的质量/g | 7.540 | 15.08 | 35.00 |
| 二氧化硫的体积/L | 0.6720 | 1.344 | 2.688 |
| 硫的质量/g | 0.8000 | 1.600 | 3.200 |
(1)计算所用硫酸溶液的物质的量浓度.
(2)分析以上数据,该样品中
A.仅含有Na2S2O3?5H2O
B.含有Na2S2O3?5H2O 和Na2SO3,无Na2SO4
C.含有Na2S2O3?5H2O、Na2SO3和Na2SO4
(3)若将22.62g该样品和一定量的上述硫酸溶液混合微热.试讨论:当加入硫酸的体积(aL)在不同取值范围时,生成的SO2体积(bL)的值(可用含a的关系式表示)
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)通过图表数据分析第三组实验数据表明,硫酸完全反应,有关化学方程式为:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O,可见无论硫酸发生那个反应都有关系式H2SO4~SO2,n(SO2)=n(H2SO4)=
=0.12mol,c=
;
(2)n(s)=
=0.1mol,则根据化学方程式Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O,可知n(Na2S2O3)=0.1mol,m(Na2S2O3 ?5H2O)=24.8g,生成二氧化硫气体物质的量为0.1mol,由Na2SO3生成的二氧化硫物质的量=0.12mol-0.1mol=0.02mol,n(Na2SO3)=0.02mol,m(Na2SO3)=0.02mol×126g/mol=2.52g,由于m(Na2S2O3 ?5H2O)+m(Na2SO3)=24.8g+2.52g=27.32g<35.00g,所以固体中含有Na2SO4;
(3)通过图表数据分析第一组实验数据,求出22.62g样品完全反应时放出的SO2气体,再求出物质的量和硫酸的物质的量,根据硫酸的浓度求出其体积;当硫酸不足时,放出气体体积依据硫酸计算.
| 2.688L |
| 22.4L/mol |
| n |
| V |
(2)n(s)=
| 3.2g |
| 32g/mol |
(3)通过图表数据分析第一组实验数据,求出22.62g样品完全反应时放出的SO2气体,再求出物质的量和硫酸的物质的量,根据硫酸的浓度求出其体积;当硫酸不足时,放出气体体积依据硫酸计算.
解答:
解:(1)通过图表数据分析第三组实验数据表明,硫酸完全反应,有关化学方程式为:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O,可见无论硫酸发生那个反应都有关系式H2SO4~SO2,n(SO2)=n(H2SO4)=
=0.12mol,c=
=
=4mol/L;
答:所用硫酸溶液的物质的量浓度4mol/L;
(2)n(s)=0.1mol,则根据化学方程式Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O,可知n(Na2S2O3)=0.1mol,m(Na2S2O3 ?5H2O)=24.8g,生成二氧化硫气体物质的量为0.1mol,由Na2SO3生成的二氧化硫物质的量=0.12mol-0.1mol=0.02mol,n(Na2SO3)=0.02mol,m(Na2SO3)=0.02mol×126g/mol=2.52g,由于m(Na2S2O3 ?5H2O)+m(Na2SO3)=24.8g+2.52g=27.32g<35.00g,所以固体中含有Na2SO4,则该样品中含有含有Na2S2O3?5H2O、Na2SO3和Na2SO4,故C正确;
故答案为:C;
(3)设22.62g样品完全反应时放出的SO2气体体积为V(SO2),
则
=
,解得:V(SO2)=2.016L,
由于H2SO4 ~SO2
1mol 22.4L
n(H2SO4) 2.016L
n(H2SO4)=
=0.09mol,
V(H2SO4)=
=
=0.0225L,
因此当a≥0.0225L时,b=2.016L,
分析第三组数据可知,当硫酸的量不足时,Na2S2O3和Na2SO3都有剩余,说明他们是同时与硫酸反应,而没先后次序.
当0<a<0.0225L时,
H2SO4 ~SO2
1mol 22.4L
aL×4mol/L bL
=
,解得:b=89.60aL,
因此当0<a<0.0225L时,b=89.60aL
答:0<a<0.0225L时,b=89.60aL,a≥0.0225L时,b=2.016L.
| 2.688L |
| 22.4L/mol |
| n |
| V |
| 0.12mol |
| 0.03L |
答:所用硫酸溶液的物质的量浓度4mol/L;
(2)n(s)=0.1mol,则根据化学方程式Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O,可知n(Na2S2O3)=0.1mol,m(Na2S2O3 ?5H2O)=24.8g,生成二氧化硫气体物质的量为0.1mol,由Na2SO3生成的二氧化硫物质的量=0.12mol-0.1mol=0.02mol,n(Na2SO3)=0.02mol,m(Na2SO3)=0.02mol×126g/mol=2.52g,由于m(Na2S2O3 ?5H2O)+m(Na2SO3)=24.8g+2.52g=27.32g<35.00g,所以固体中含有Na2SO4,则该样品中含有含有Na2S2O3?5H2O、Na2SO3和Na2SO4,故C正确;
故答案为:C;
(3)设22.62g样品完全反应时放出的SO2气体体积为V(SO2),
则
| 22.62g |
| 15.08g |
| V(SO2) |
| 1.344L |
由于H2SO4 ~SO2
1mol 22.4L
n(H2SO4) 2.016L
n(H2SO4)=
| 1mol×2.016L |
| 22.4L |
V(H2SO4)=
| n |
| V |
| 0.09mol |
| 4mol/L |
因此当a≥0.0225L时,b=2.016L,
分析第三组数据可知,当硫酸的量不足时,Na2S2O3和Na2SO3都有剩余,说明他们是同时与硫酸反应,而没先后次序.
当0<a<0.0225L时,
H2SO4 ~SO2
1mol 22.4L
aL×4mol/L bL
| 1mol |
| aL×4mol/L |
| 22.4L |
| bL |
因此当0<a<0.0225L时,b=89.60aL
答:0<a<0.0225L时,b=89.60aL,a≥0.0225L时,b=2.016L.
点评:本题考查了物质组成的探究分析,数据分析判断,反应产物和反应过程的理解应用,掌握题干信息是解题关键,题目难度较大,侧重于考查学生的分析能力和数据处理能力.

练习册系列答案
相关题目
1g氢气燃烧生成液态水,放出142.9KJ热量,下列表示该反应的热化学方程式正确的是( )
| A、2H2(g)+O2(g)→2H2O(l)+14.29 KJ |
| B、H2(g)+O2(g)→H2O(l)+285.8 KJ |
| C、2H2+O2→2H2O+571.6 KJ |
| D、2H2(g)+O2(g)→2H2O(l)-571.6 KJ |
X是铁与硫在隔绝空气的条件下反应后所得固体,倾斜A使稀硫酸(足量)与固体X充分反应,等反应停止后,B装置质量增加,C装置中溶液无变化.反应后进入量气管气体的体积VmL(已折算成标准状况),下列说法正确的是( )
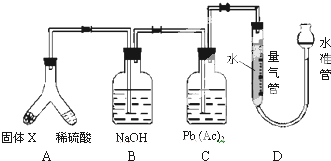

| A、固体X中一定有的物质是FeS、Fe 和S |
| B、B装置中的溶质一定是Na2S |
| C、C装置的作用是检验H2S是否完全被吸收 |
| D、X中其中一种物质的质量为V/400g |
下列有关化学反应中能量变化的叙述错误的是( )
| A、已知2H2(g+O2(g)=2H2O(g)△H=-483.6kJ/mol,则H2的燃烧热为241.8kJ/mol |
| B、稀氢氧化钠溶液与稀盐酸溶液中和,H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol |
| C、应用盖斯定律,可计算某些难以直接测量的反应焓变 |
| D、需要加热才能发生的反应不一定是吸热反应 |
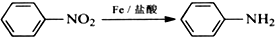
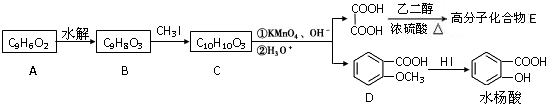
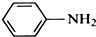 苯胺,弱碱性,-NH2易被氧化成-NO2
苯胺,弱碱性,-NH2易被氧化成-NO2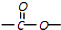 结构;
结构;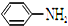 最多能够和
最多能够和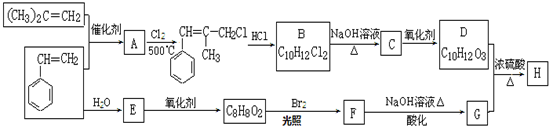
 现有A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大,D与E同主族,且D的氢化物常温时为液态.A、B的最外层电子数之和与C的最外层电子数相等,A分别与B、C、D形成电子总数相等的分子.
现有A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大,D与E同主族,且D的氢化物常温时为液态.A、B的最外层电子数之和与C的最外层电子数相等,A分别与B、C、D形成电子总数相等的分子.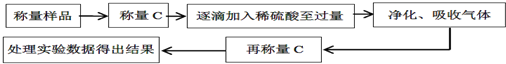
 CH3COOH+CH3CH2COOH
CH3COOH+CH3CH2COOH