题目内容
6. 按要求填空:
按要求填空:(1)有下列物质:①铜;②石灰水;③CO2;④Na2SO4固体;⑤CaO.其中属于混合物的是②(填序号,下同),属于碱性氧化物的是⑤;写出Na2SO4在水溶液中的电离方程式:Na2SO4=2Na++SO42-.
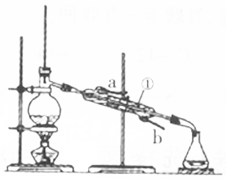
(2)如图装置中仪器①的名称是冷凝管,水流的方向是从b(填“a”或“b”)口进入.
(3)实验室常用KSCN溶液(填试剂)检验Fe3+的存在,现象是溶液变为血红色.
(4)19g MgCl2中Mg2+的物质的量是0.2mol.
分析 (1)不同物质组成的为混合物,和酸反应生成盐和水的化合物为碱性氧化物,硫酸钠水溶液中完全电离生成钠离子和硫酸根离子;
(2)装置图中仪器为冷凝管,冷凝效果好需要逆流;
(3)检验铁离子的试剂为KSCN溶液,铁离子结合硫氰根离子形成血红色溶液;
(4)n=$\frac{m}{M}$,n(Mg2+)=n(MgO);
解答 解:(1)①铜是单质为纯净物;
②石灰水是氢氧化钙的水溶液为混合物;
③CO2是酸性氧化物为纯净物;
④Na2SO4固体为盐属于纯净物;
⑤CaO为纯净物,和酸反应生成盐和水为碱性氧化物;
其中属于混合物的是②,属于碱性氧化物的是⑤,Na2SO4在水溶液中的电离方程式为:Na2SO4=2Na++SO42-,
故答案为:②;⑤;Na2SO4=2Na++SO42-;
(2)装置中仪器①的名称是冷凝管,水流的方向是从b口进入,故答案为:冷凝管;b;
(3)检验Fe3+的存在用KSCN溶液,铁离子结合SCN-离子形成血红色溶液,故答案为:KSCN溶液;溶液变为血红色;
(4)19g MgCl2中Mg2+的物质的量:n(Mg2+)=n(MgO)=$\frac{19g}{95g/mol}$=0.2mol,
故答案为:0.2;
点评 本题考查了物质分类、物质组成、蒸馏装置注意问题、离子检验方法等,掌握基础是解题关键,题目难度不大.

练习册系列答案
相关题目
16.下列物质的水溶液因水解呈酸性的是( )
| A. | SO2 | B. | AlCl3 | C. | NaHCO3 | D. | NaHSO4 |
17.升髙温度能加快反应速率的主要原因是( )
| A. | 活化分子的能量明显增加 | B. | 改变了化学反应的能量变化 | ||
| C. | 降低了反应的活化能 | D. | 增加了活化分子的百分数 |
14.下列说法或表不方法正确的是( )
| A. | 在稀溶液中,H+(aq)+OH-(aq)═H2O(1)△H;若将0.5molH2SO4的浓硫酸与含1 molNaOH的溶液混合的反应热大于△H | |
| B. | (NH4)2CO3(s)═NH4HCO3(s)+NH3(g)△H=+74.9KJ/mol,该反应是吸热反应,因此一定不能自发进行 | |
| C. | 只含NH4+、Cl-、H+、OH-四种离子的溶液中离子浓度可能满足:c(Cl-)>c(H+)>c(NH4+)>c(OH-) | |
| D. | 降低温度和加水稀释,都会使NH4Cl 溶液中c(H+)变小,水解平衡向逆方向移动 |
11.下列化合物中,不能由单质直接化合生成的是( )
| A. | FeCl3 | B. | FeS | C. | CuS | D. | CuCl2 |
18.X、Y、Z、W四种气体都是污染大气的物质,其中Y跟W按一定体积比相遇时可消除气体的毒性;Y跟Z相遇时,可使气体的红棕色变浅;Y与Z分别是引起酸雨的主要物质,这四种气体依次是( )
| A. | H2S、NO、HCl、SO2 | B. | SO2、HCl、NO2、H2S | C. | H2S、NO2、Cl2、SO2 | D. | Cl2、SO2、NO2、H2S |
15.质量分数为25%的氨水的密度是0.92g/cm3,质量分数为5%的氨水的密度是0.98g/cm3,将这两种氨水等体积混合,混合后所得氨水的质量分数( )
| A. | 等于15% | B. | 大于15% | C. | 小于15% | D. | 无法判断 |