题目内容
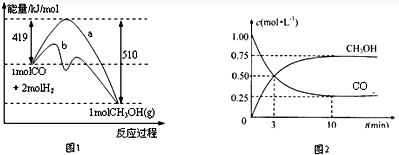
17.降低大气中CO2的含量及有效地开发利用CO2,已引起了各国的普遍重视.工业上用CO、CO2来生产燃料甲醇、乙醇.(1)图1表示CO(g)和H2(g)生成CH3OH(g)的反应过程中能量的变化(曲线a未使用催化剂,曲线b使用催化剂).写出该条件下该反应的热化学方程式:CO(g)+2H2(g)=CH3OH(g)△H=-91 kJ/mol.
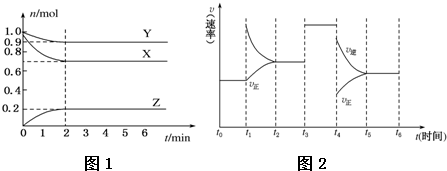
(2)为探究反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)的原理,在体积为1L的密闭容器A中,充入1molCO2和3molH2,一定条件下发生反应,测得CO2和CH3OH(g)的浓度随时间变化如图2所示.
①从反应开始到平衡,H2的平均反应速率v(H2)=0.225mol/(L.min);CO2的转化率为75%.
②该温度下,反应达到平衡时,下列关系式正确的是a(填序号).
a.v正(CO2)=v逆(H2O(g)) b.$\frac{{P}_{起始}}{{P}_{平衡}}$=2 c.v正(H2)=v逆(CO2)d.$\frac{{P}_{起始}}{{P}_{平衡}}$=1.
③该温度下,反应的平衡常数=$\frac{16}{3}$.
④若在体积1L的密闭容器B中,充入2molCO2和6molH2,在与A相同的条件下达到平衡,则两容器中H2的转化率:A容器<B容器(填“<”“>”或“=”).
(3)工业上以CO2和H2为原料合成乙醇:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g),在一定压强下,测得的实验数据如下表:
| 温度(K) CO2转化率(%) n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | X | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
②表中X的取值范围是33<X<60.
分析 (1)由图可知,1molCO(g)与2molH2(g)反应生成1molCH3OH(g)放出的热量为419kJ-510kJ=91kJ,注明物质的聚集状态与反应热书写热化学方程式;
(2)在体积为1L的密闭容器A中,充入1molCO2和3molH2,10min到达平衡,平衡时CO2和CH3OH(g)的浓度分别为0.25mol/L、0.75mol/L,则:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始浓度(mol/L):1 3 0 0
变化浓度(mol/L):0.75 2.25 0.75 0.75
平衡浓度(mol/L):0.25 0.75 0.75 0.75
①根据v=$\frac{△c}{△t}$计算v(H2),转化率=$\frac{浓度变化量}{起始浓度}$×100%;
②反应到达平衡时,不同物质表示的正逆速率之比等于其化学计量数之比,压强之比等于总物质的量浓度之比;
③根据K=$\frac{c(C{H}_{3}OH)×c({H}_{2}O)}{c(C{O}_{2})×{c}^{3}({H}_{2})}$计算平衡常数;
④若在体积1L的密闭容器B中,充入2molCO2和6molH2,等效为在A容积中平衡基础上增大压强,平衡正向移动,反应物转化率增大;
(3)①由表中数据可知,n(H2):n(CO2)一定时,温度越高二氧化碳的转化率越小,说明升高温度平衡逆向移动;
②增大氢气物质的量,有利于平衡正向移动,二氧化碳转化率增大,而温度越高二氧化碳的转化率越小.
解答 解:(1)由图可知,1molCO(g)与2molH2(g)反应生成1molCH3OH(g)放出的热量为419kJ-510kJ=91kJ,热化学方程式为CO(g)+2H2(g)=CH3OH(g)△H=-91 kJ/mol,
故答案为:CO(g)+2H2(g)=CH3OH(g)△H=-91 kJ/mol;
(2)在体积为1L的密闭容器A中,充入1molCO2和3molH2,10min到达平衡,平衡时CO2和CH3OH(g)的浓度分别为0.25mol/L、0.75mol/L,则:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始浓度(mol/L):1 3 0 0
变化浓度(mol/L):0.75 2.25 0.75 0.75
平衡浓度(mol/L):0.25 0.75 0.75 0.75
①v(H2)=$\frac{2.25mol/L}{10min}$=0.225mol/(L.min),CO2转化率=$\frac{0.75mol/L}{1mol/L}$×100%=75%,
故答案为:0.225mol/(L.min);75%;
②反应到达平衡时,不同物质表示的正逆速率之比等于其化学计量数之比,则平衡时:v正(CO2)=v逆(H2O(g),v正(H2)=3v逆(CO2),压强之比等于总物质的量浓度之比,则$\frac{{P}_{起始}}{{P}_{平衡}}$=$\frac{1+3}{0.25+0.75×3}$=$\frac{8}{5}$,
故选:a;
③该温度下,平衡常数K=$\frac{c(C{H}_{3}OH)×c({H}_{2}O)}{c(C{O}_{2})×{c}^{3}({H}_{2})}$=$\frac{0.75×0.75}{0.25×0.7{5}^{3}}$=$\frac{16}{3}$,
故答案为:$\frac{16}{3}$;
④若在体积1L的密闭容器B中,充入2molCO2和6molH2,等效为在A容积中平衡基础上增大压强,平衡正向移动,反应物转化率增大,两容器中H2的转化率:A容器<B容器,
故答案为:<;
(3)①由表中数据可知,n(H2):n(CO2)一定时,温度越高二氧化碳的转化率越小,说明升高温度平衡逆向移动,平衡常数减小,
故答案为:减小;
②增大氢气物质的量,有利于平衡正向移动,二氧化碳转化率增大,而温度越高二氧化碳的转化率越小,故X的取值范围为:33<X<60,
故答案为:33<X<60.
点评 本题考查化学平衡计算与影响因素、化学平衡状态、反应速率计算、平衡常数、热化学方程式书写等,是对学生综合能力的考查,难度中等.

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案(1)步骤1:
| 加入试剂 | 被检出物质 | 理由 |
| 水 | CuSO4 | CuSO4溶于水溶液显蓝色 |
| 加入试剂 | 被检出物质 | 离子方程式 |
| CuSO4 |
| 加入试剂 | 被检出物质 | 离子方程式 |
| MgCl2 |
| A. |  装置依据U管两边液面的高低判断Na和水反应的热效应 | |
| B. |  装置依据测定酸碱中和反应的中和热 | |
| C. |  装置依据出现浑浊的先后顺序,比较浓度对反应速率的影响 | |
| D. |  装置依据两容器内气体颜色变化,判断反应2NO${\;}_{{2}_{\;}}$(g)?N2O4(g)平衡移动的方向 |
| A. | 熔化状态下能导电的物质一定是离子化合物 | |
| B. | 单质分子中一定含有共价键 | |
| C. | 只由非金属元素组成的化合物不一定是共价化合物 | |
| D. | 不同元素组成的多原子分子里的化学键只存在极性键 |
| A. | 大理石和稀盐酸反应CO32-+2 H+═CO2↑+H2O | |
| B. | 铜和稀硝酸反应3Cu+8H++2 NO3-═3Cu2++2NO↑+4H2O | |
| C. | 氢氧化钡溶液加入稀硫酸中:OH-+H+═H2O | |
| D. | 铝和烧碱溶液反应 A1+2OH-═A1O2-+H2↑ |
 (1)2mol O3和 3mol O2的质量之比为1:1,分子数之比为2:3,同温同压下的密度之比为3:2,含氧原子数之比1:1,体积之比为2:3.
(1)2mol O3和 3mol O2的质量之比为1:1,分子数之比为2:3,同温同压下的密度之比为3:2,含氧原子数之比1:1,体积之比为2:3.